《常见的金属和盐》测试题
《常见的金属和盐》测试题
1、单选题
1.科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图。下列说法不正确的是![]()
![]()
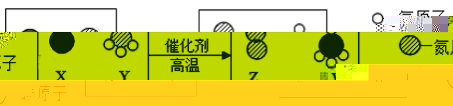
A.参加反应的X、Y两物质的粒子个数比为3:4
B.该反应是置换反应
C.W物质中碳元素的水平分数为![]()
D.化学反应前后原子的类型、个数、水平均维持不变
2.下列反应是置换反应的是( )
A.CaO + H2O = Ca2 B.H2CO3 = H2O + CO2↑
C.Fe + CuSO4 = FeSO4 + Cu D.3 CO + Fe2O3 ![]() 2Fe + 3CO2
2Fe + 3CO2
3.下列说法正确的是 ( )
A.催化剂有哪些用途是加快反应速率 B.生石灰放入水中,吸热,温度升高
C.铁器在干燥的空气中不容易生锈 D.节省用水对沿海城市意义不大
4.除去下列物质中所含的少量杂质,办法正确的量( )。
| 物质 | 所含杂质 | 除去杂质的办法 |
A | 二氧化锰 | 氯化钠 | 加水溶解,过滤,蒸发结晶 |
B | 氯化钠溶液 | 碳酸钠 | 加入过量稀盐酸,加热蒸发 |
C | 氯化钙溶液 | 稀盐酸 | 加入过量氢氧化钙,过滤 |
D | 氢氧化钠溶液 | 碳酸钠 | 加入适当石灰水,过滤 |
A.A B.B C.C D.D
5.下列说法正确的是()
A.农药有毒,禁止用农药
B.pH>7肯定是碱的溶液
C.尿素和磷矿粉从外观即可区别
D.浓硫酸蘸到皮肤上可用3%﹣5%的氢氧化钠溶液处置
6.下列物质的检验或除杂办法,不正确的是( )
A.除去CaCO3 固体含少量CaO —高温煅烧 B.辨别H2和CO2——可用燃着的木条辨别
C.除去N2中少量O2 ——通过灼热的铜网 D.除去FeSO4溶液中混有些CuSO4—过量铁粉
7.下列排序正确的是
A.借助金属的年代![]() B.铁元素水平分数
B.铁元素水平分数![]()
C.碳元素的化合价:![]() D.金属的活动性
D.金属的活动性![]()
8.下列有关金属及合金的说法错误的是()
A.常温下所有些金属都是固体 B.铁制品在潮湿的空气中易生锈
C.生铁和不锈钢都是金属材料 D.铝片表面易生成致密的氧化膜
9.下列有关金属材料的说法正确的是
A.生铁比纯铁硬度小
B.不锈钢的抗腐蚀性比纯铁的好
C.钢的含碳量比生铁的含碳量高
D.沙漠区域的铁制品比沿海区域的铁制品锈蚀得快
10.将一块生铁浸入足量的稀硫酸中,充分反应后,下列叙述:①生铁表面产生气泡;②溶液由无色渐渐变为浅绿色;③固体水平减轻;④最后没固体残留。其中正确的是
A.①③ B.①②③ C.①②④ D.①②③④
11.大家的衣、食、住、行中蕴含着丰富的化学常识。下列说法不正确的是( )
A.钙、镁、铁、锌都是常量元素
B.食用加碘食盐和强化铁酱油可补充某些人体必需的微量元素
C.建造高楼大厦时所用到的钢和生铁是铁的两种合金
D.缺锌会引起食欲不振,成长迟缓,发育不好的
12.下列事实与讲解相符的是
A.干冰用作制冷剂——干冰是冰
B.纯碱溶液使酚酞试液变红——纯碱是碱
C.制糖工业用活性炭脱色制白糖——活性炭和有色物质反应
D.用炭黑墨汁书写的字经久不变色——常温下,碳的化学性质稳定
13.在围绕太阳运行的行星中,地球称为“蓝色星球”,而火星称为“红色星球”,火星表面的土壤和岩石多为红褐色,据此可推断火星表面的土壤和岩石中含有很多的
A.氧化铜 B.氧化铝 C.四氧化三铁 D.氧化铁
2、实验题
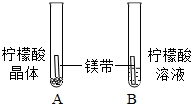
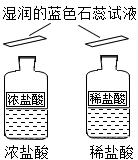
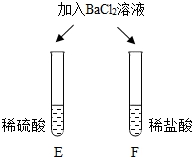
14.对比学习有益于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 剖析与结论 |
| A试管内_____,B试管中镁带表面冒气泡。 | 酸的不少反应一般在水溶液中才能完成。 |
| _____(填“浓”或“稀”)盐酸瓶口的蓝色石蕊试纸非常快变红。 | 即便是同种酸,因为_____不同,它们的性质不一模一样。 |
| 两试管中均产生_____ | 不一样的酸具备一样的性质,这是由于酸的组成中都含有_____(填元素符号). |
| E试管中产生_____,F试管中没有明显现象。 | 不一样的酸根会致使酸的“个性”差异。因此,可用氯化钡溶液辨别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请剖析上述现象并回答:
Ⅰ.废液缸中产生气体的反应的化学方程式为_____。
Ⅱ.废液缸里最后产生的白色沉淀中肯定有硫酸钡,可能有_____(填化学式)。
15.如图为家庭制氧机内桶架构示意图,桶上设有制氧剂投药口和出气口.已知:
i.制氧剂的主要成分是过碳酸钠和催化剂
ii.本商品用于人体保健吸氧,产生的氧气需通入水中净化.
(1)制氧时,从投药口中投入药品后,立马上其关闭.
①过碳酸钠加入水中后,分解产生过氧化氢;过氧化氢再在催化剂有哪些用途下产生氧气.过氧化氢发生反应的化学方程式为_____.
②氧气的出口为_____(填“a”或“b”).
(2)若在装置的Ⅰ、Ⅱ中放入其它试剂,可进行以下实验.
①检验碳酸盐:实验过程中,从a或b处加入试剂后,需将产生气体的一侧(a或b)密闭.其中,Ⅰ中盛放的试剂是_____.
②研究金属性质:I中加入铁屑和过量稀盐酸,II中只加入锌粒,关闭a口.一段时间后,II中可以察看到的现象有_____.
3、判断题
16.如图所示,“﹣”表示相连的两物质可发生反应,“→”表示可以向箭头所指方向一步转化,部分反应物、生成物均已略去;所涉及的物质和反应在初中化学中均较容易见到,且A﹣E为五种不相同种类别的物质(指单质、氧化物、酸、碱、盐),A的浓溶液在实验室中常用作干燥剂。请回答下列问题:

(1)A的化学式为_____。
(2)D与E的化学方程式可能为_____(写一个即可)。
4、计算题
17.某化学兴趣小组同学为收购一块水平为40g的铜锌合金中的铜,将该合金放入烧杯中,渐渐加入稀硫酸至不再产生气泡时,恰好使去稀硫酸100g,烧杯内剩余固体水平为27g。
请完成下列剖析及计算:
(1)40g铜锌合金中锌的水平是_______g。
(2)计算所用稀硫酸中溶质的水平分数_____________。
18.向盛有26.4 g硫酸钠和碳酸钠混合物的烧杯中加入218 g稀硫酸,恰好完全反应,固体全部消失,烧杯内物质总水平降低了4.4 g。请计算下列各题。
(1)原混合物中碳酸钠的水平。
(2)反应后所得溶液中溶质的水平分数。
19.将10克铁粉加入盛有100克稀盐酸的烧杯中,充分反应后,发现铁粉有剩余,并称得烧杯内物质的总水平为109.8克。
求:(1)生成氢气的水平为_________g.
(2)所用稀盐酸的溶质水平分数_______?
参考答案
1.C 2.C 3.C 4.D 5.C 6.A 7.C 8.A 9.B 10.B 11.A 12.D 13.D
14.没有明显现象 浓 溶质水平分数 气泡 H+ 白色沉淀 Na2CO3+2HCl=2NaCl+H2O+CO2↑ BaCO3
15.2H2O2 2H2O+O2↑ a 澄清石灰水 I中溶液进入II中,II中产生无色气体.
2H2O+O2↑ a 澄清石灰水 I中溶液进入II中,II中产生无色气体.
16.H2SO4 2NaOH+CO2=Na2CO3+H2O
17.13 19.6%
18.(1)10.6g(2)12.5%
19.0.2 7.3%。