第二学期三林北校初三首次阶段测试题(化学)
所需相对原子水平:Na-23 Cl-35.5
1、选择题(20 分)
1. 以下不是酸的是
A. HNO3 B. H2CO3 C. Na2CO3 D. H2S
2. 酚酞试液在 pH=8 的溶液显
A. 紫色 B. 红色 C. 无色 D. 蓝色
3. 下列金属活动性顺序,排列正确的是
A. Zn>Cu>Mg B. Zn>Mg>Cu C. Mg>Fe>Cu D. Fe>Mg>Zn
4. 下列金属中,不可以由金属跟盐酸直接制取的是
A. FeCl2 B. CuCl2 C. ZnCl2 D. MgCl2
5. 能与硝酸银溶液反应,但不可以与盐酸反应的是
A. Zn B. Fe C. Cu D. Ag
6. 有关物质的作用错误的是
A. 稀少气体制成多作用与功效的电光源 B. 活性炭作吸附剂
C. 无水硫酸铜用于检验酒精中是不是含水 D. 熟石灰可治疗胃酸过多
7. 下列反应中是中和反应的是
A. Fe2O3+6HCl→2FeCl3+3H2O B. 2HCl+Ca2→CaCl2+2H2O
C. 2HCl+Na2CO3→2NaCl+H2O+CO2↑ D. Ca2+CO2→CaCO3↓+H2O
8. 下列物质可能是酸碱中和的产物的是
A. 生石灰 B. 硫酸铜 C. 烧碱 D. 硝酸
9. 用天平称量固体氢氧化钠时,应把氢氧化钠固体放在
A. 试管中 B. 小烧杯内 C. 称量纸上 D. 天平的托盘上
10. 试管内附着的不溶性碱可用下列哪种物质洗涤
A. NaOH B. NaCl C. HCl D. H2O
11. 稀盐酸可用于清洗金属表面,下列物质间的反应可以说明盐酸的这一作用与功效的是
A. 铁和盐酸 B. 氢氧化铜和盐酸 C. 氧化铁和盐酸 D. 氢氧化钠和盐酸
12. 下列是碱性氧化物的是
A. 水 B. 二氧化碳 C. 五氧化二磷 D. 氧化铁
13. 下列物质的名字、俗称、化学式不同的是
A. 氧化钙 消石灰 CaO B. 氢氧化钠 烧碱 NaOH
C. 碳酸钙 大理石 CaCO3 D. 氢氧化钙 熟石灰 Ca2
14. 下列试剂可用于辨别稀硫酸和稀盐酸的是
A. 石蕊试剂 B. 硝酸银溶液 C. 氯化钡溶液 D. 酚酞试液
15. 辨别氢氧化钠的稀溶液和饱和的氢氧化钙溶液,下列办法不可以达到目的的是
A. 分别滴入稀盐酸 B. 分别加热原溶液
C.分别滴加碳酸钠溶液 D. 分别通入二氧化碳
16. 下列实验设计能达成其对应的实验目的的是
 |
 |
 |
 |
A. 测定空气中 O2 的含量
B. 能证明 CO2 与溶液反应
C. 比较 MnO2 和 Fe2O3
的催化成效
D. 此装置具备“启普发生器”的功能
17. 设计实验判断 Fe、Cu、Ag 的金属活动性顺序正确的是
A. 铁丝分别放入硝酸铜溶液和硝酸银溶液
B. 铁丝放入硝酸铜溶液,铜丝放入硝酸银溶液
C. 铜丝放入硝酸亚铁溶液,铁丝放入硝酸银溶液
D. 银丝分别放入硝酸铜溶液和硝酸亚铁溶液
18. 用石灰水、铜片、盐酸、碳酸钠、石灰石五种物质进行下列实验没办法完成的是
A. 制取氢氧化钠 B. 制取氯化铜 C. 制取二氧化碳 D. 制取生石灰
19. 在 AgNO3 和 Cu2 的混合液中加入适量的铁粉,充分反应后,有少量金属析出,过滤后,向滤液中滴加稀盐酸,有白色沉淀产生,则理论上析出的少量金属是
A. Ag B. Cu C. Fe 和 Cu D. Cu 和 Ag
20. 化学实验课上,某同学向含有稀硫酸的硫酸铜溶液中,逐滴滴入 NaOH 溶液至过量。记录滴入 NaOH
溶液水平(x)与有关量的变化关系如图所示(提示:硫酸铜溶液呈酸性),下列判断错误的是
A.  图中纵坐标(y)表示生成 Cu2 的水平
图中纵坐标(y)表示生成 Cu2 的水平
B. 反应进行到 B 点时,溶液中的溶质是 Na2SO4
C. AB 段溶液的 pH 渐渐增大
D. B 点和 C 点溶液的 pH 相等
2、填空题(21 分)
1. 在 Ca、Na、O、H、C、Cl、S 元素中,选择合适的元素,组成符合下列需要的物质,将它化学式填入空格中。
(1)用来清除铁锈的一元酸是____________________。
(2)用于调味剂的是____________________。
(3)用于减少土壤酸性的是____________________。
(4)用作气体干燥剂的是____________________。
(5)家庭用的天然气主要成分是____________________,它是____________________(填“有机物”或“无机物)。
2. 农村用草木灰作为化肥,它的主要成分是碳酸钾,其水溶液显____________________(填酸性、碱性、中性),用它 做焰色反应,通过蓝色钴玻璃片,看到火焰的颜色呈____________________色。
3. 纯净的盐酸是无色的有刺激性气味的液体;浓盐酸具备____________________性,敞口放置在空气中,瓶口会有____________________
产生。浓硫酸可以做不少气体的干燥剂,由于它有____________________性。
4. 将一枚生锈的铁钉放入足量的稀硫酸中,现象是______________________________;反应的化学方程 式有____________________;____________________。
5. 氢氧化钠固体易溶解于水,且____________________(填”放“或”吸“)热,它暴露在空气中容易吸收水分,表面潮湿 而逐步溶解,可做某些气体的干燥剂,但不可以干燥二氧化碳气体,用化学方程式表示缘由
______________________________;氢氧化钙固体____________________(填写“易溶”“微溶”“难溶”)于水,它的溶解度随 温度的升高而____________________,在空气中会吸收二氧化碳而变质,写出检验熟石灰是不是变质的化学方程式
____________________。
6. 要除去硫酸亚铁溶液中混有些少量硫酸铜杂质,可以在溶液中加入____________________,再过滤除去杂质,有关 的化学方程式为____________________。
3、简答卷(19 分)
1.  在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验。
在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验。
(1)甲组在实验过程中测定了其中一种溶液的 pH 变化,由图可知,该小组同学测定的是____________________溶液的 pH 变化,该反应的化学方程式为
____________________。
实验过程中,同学们取了右图中 A 点所得溶液,加入试剂____________________(填序号),察看到有蓝色沉淀生 成。
I. BaCl2 溶液 II. Fe23 溶液 III. CuSO4 溶液
结论:酸碱没恰好中和,A 点溶液中的溶质为____________________。
(2)乙组向滴有酚酞的氢氧化钠溶液中滴加稀硫酸,可察看到____________________。结论:酸碱可能恰好中和,也会硫酸过量。
为了进一步确定反应后所得溶液中是不是含有硫酸,乙组同学设计了如下两种策略:
策略1、取反应后溶液于试管中,滴加碳酸钠溶液,若察看到____________________,则硫酸过量; 策略2、取反应后溶液于试管中,滴加氢氧化钡溶液,若产生白色沉淀,则硫酸过量。
你觉得上述两种策略,哪种不合理?并说明理由____________________。
2. 下列各图是 O2、CO2 的实验室制取和有关性质的实验装置。
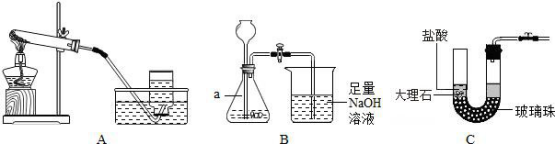 |
①写出标号 a 的仪器名字:____________________。
②用氯酸钾和二氧化锰固体制取 O2,应使用上图中的____________________装置(填字母);反应的化学方程式为
____________________。
③用稀盐酸和大理石在 B 装置中反应制取 CO2 并检验其有关性质,察看到烧杯中导管口有气泡冒出,但无其它明显现象。若证明 CO2 与 NaOH 溶液发生了化学反应,以下策略适当的是____________________(填序号)。
I. 取少量烧杯中液体滴加足量稀盐酸
II. 取少量烧杯中液体滴加无色酚酞
III. 取少量烧杯中液体滴加氯化钡溶液
④C 装置____________________(填“具备”或“不具备”)启普发生器功能。
3.
 |
用含有少量 CaCl2 的 NaCl 固体,配制浓度为 10%的食盐溶液。实验步骤如下图:
(1)加入的 X 为____________________,发生反应的化学方程式____________________。加入的 Y 为____________________。
4. 向适量氯化钠溶液中加入足量硝酸银溶液,得到 0.002mol 氯化银固体,则该氯化钠溶液中氯化钠的水平为____________________g(依据化学方程式列式计算)。
参考答案
1、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C | B | C | B | C | D | B | B | B | C |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
C | D | A | C | A | B | B | B | A | D |
2、填空题
1.(1)HCl (2)NaCl (3)Ca2 (4)CaO、NaOH (5)CH4;有机物
碱性;紫
挥发;白雾;吸水
铁锈消失,溶液由无色变为黄色,一段时间后有气泡产生;Fe2O3+6HCl→2FeCl3+3H2O;
Fe+2HCl→FeCl2+H2↑
放;CO2+2NaOH→Na2CO3+H2O;微溶;减小;CaCO3+2HCl→CaCl2+H2O+CO2↑
铁粉;Fe+CuSO4→Cu+FeSO4 3、简答卷
1. (1)NaOH;2NaOH+H2SO4→Na2SO4+2H2O;Ⅲ;Na2SO4 和 NaOH
![]() (2)红色变为无色;冒气泡;策略二不合理,由于 Na2SO4 与 Ba2 反应也生成白色沉淀2. ①锥形瓶;②A;2KClO3 ¾M¾nO¾2 ® 2KCl+3O2↑;③Ⅰ和Ⅲ;④不具备
(2)红色变为无色;冒气泡;策略二不合理,由于 Na2SO4 与 Ba2 反应也生成白色沉淀2. ①锥形瓶;②A;2KClO3 ¾M¾nO¾2 ® 2KCl+3O2↑;③Ⅰ和Ⅲ;④不具备
3. (1)Na2CO3;CaCl2+Na2CO3→CaCO3↓+2NaCl;盐酸
4. 1.17







