第五单元 化学方程式 课题3 借助化学方程式的简单计算 (测试)
(时间:45分钟 满分:100分)
学校:___________ 名字:__________ 班级:__________ 得分:
1、单选题(7个小题,每小题5分,共35分)
1、肯定条件下,在一个密闭容器中发生某反应,测得反应过程中物质的水平如下表所示:
物质 | X | Y | Z | Q |
首次测得的水平/g | 68 | 16 | 4.4 | 3.6 |
第二次测得的水平/g | 4 | 未测 | 48.4 | 39.6 |
下列判断错误的是
A.该反应肯定是中和反应 ![]() B.若X为氧气,则Y肯定发生氧化反应
B.若X为氧气,则Y肯定发生氧化反应
C.第二次测量时,Y已完全参加反应 D.该反应中Z与Q水平变化之比为11:9
【答案】A
【分析】:A、由于反应物和生成物的类型没办法确定,所以不可以确定反应种类.错误; B、若X为氧气,则Y肯定发生氧化反应.正确; C、第二次测量时,Y已完全参加反应.正确; D、该反应中z与Q水平变化之比为:44g:36g=11:9.正确.故选A.
2.在反应X+2Y====R+2M中,当1.6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的水平之比为11∶9,则在此反应中Y和M的水平之比为
A.23∶9 B.16∶9 C.32∶9 D.46∶9
【答案】B
【分析】:此题考查的常识是物质之间发生的反应按肯定的水平比进行,反应物和生成物的水平总和相等(即水平守恒)。
设生成M的水平为x。
X+2Y====R + 2M
11 9
4.4 g x
(1)11/4.4 g=9/x,x= 3.6 g。
(2)依据水平守恒定律:Y的水平为:4.4 g+3.6 g-1.6 g=6.4 g。
Y和M的水平之比是:6.4 g∶3.6 g=16∶9。学科~网
3.下图表示治理汽车尾气所涉及反应的微观过程。下列说法正确的是
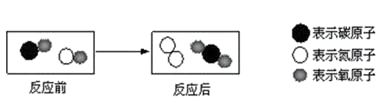
A.图中涉及的物质均为氧化物 B.反应物和生成物均含有毒气体
C.生成单质与化合物的水平比为7:22 D.生成物的分子个数比为1:1
【答案】 C
【分析】:依据题中的图示及微观结构示意图可知A.图中涉及的物质均为氧化物是不对的叙述,氮气是单质;B.反应物和生成物均含有毒气体是不对的叙述,生成物中没有毒气体;C选项 C.生成单质与化合物的水平比为7:22是正确的叙述;D选项生成物的分子个数比为1:1 是不对的叙述,生成物的分子个数比为1:2,故选C
4、如图所示,实验室制取氧气时,在试管中加热适量高锰酸钾固体,伴随反应的发生,纵坐标表示的是

A.高锰酸钾的水平 B.氧气的水平
C.锰元素的水平分数 D.固体物质的水平
【答案】D

5.工业上用甲、乙制备化学肥料丙,同时有丁生成。依据下列微观示意图得出的结论中,正确的是

①4种物质中,是氧化物的是乙、丁 ②丙中氮、氢原子个数比为1:2
③参加反应的甲、乙水平比为17:44 ④反应中乙、丁的分子个数比为1:1
A.①②③ B.①②④ C. ②③④ D.①②③④
【答案】B
【分析】:由图片信息可知:2NH3+C![]() O2====CO2+H2O,乙、丁分别是CO2 和H2O,是氧化物,①正确;②丙的化学式为CO2,氮、氢原子个数比为1:2,故正确;③参加反应的甲、乙水平比为34:44,错误;④反应中乙、丁的分子个数比为1:1正确,故选A。
O2====CO2+H2O,乙、丁分别是CO2 和H2O,是氧化物,①正确;②丙的化学式为CO2,氮、氢原子个数比为1:2,故正确;③参加反应的甲、乙水平比为34:44,错误;④反应中乙、丁的分子个数比为1:1正确,故选A。
6、在反应X+2Y![]() R+2M中,当32 gY与X恰好完全反应后,生成18 g M,且生成的R和M的水平比为11∶9,则在此反应中,参加反应的X与生成的R的水平比为
R+2M中,当32 gY与X恰好完全反应后,生成18 g M,且生成的R和M的水平比为11∶9,则在此反应中,参加反应的X与生成的R的水平比为
A.4∶11 B.16∶9 C.8∶11 D.32∶9
【答案】A
【分析】:因反应生成18 g M,且生成的R和M的水平比为11∶9,故反应生成R 22 g,依据水平守恒定律得参加反应的X为8 g,则参加反应的X与生成的R的水平比为8 g∶22 g=4∶11。
7.镁在空气中燃烧时,发生如下两个反应:3Mg+N2__________Mg3N2,2Mg+O2__________2MgO。已知24 g镁在纯氧中完全燃烧可得40 g产物,那样24 g镁在空气中完全燃烧所得产物的水平。
A.等于40 g B.小于40 g C.大于40 g D![]() .没办法确定
.没办法确定
【答案】B
【分析】:设![]() 24 g镁在纯氮气中完全燃烧可得Mg3N2为x。
24 g镁在纯氮气中完全燃烧可得Mg3N2为x。
3Mg+N2__________Mg3N2
3×243×24+2×14
24 g x
24=x
解得x=33.3 g
现24 g镁在空气中完全燃烧所得产物的水平肯定介于33.3 g和40 g之间。所以选B。
2、计算题:(每小题13分,共65分)
1.已知在反应3A+2B====2C+D中,反应物A、B的水平比为3∶4。当反应生成C和D的水平共140 g时,B消耗的水平为___________g。
【答案】80
【分析】:此题能根![]() 据水平守恒定律,因为生成物C和D的水平共140 g,所以A和B的水平之和也应为140 g。因为反应
据水平守恒定律,因为生成物C和D的水平共140 g,所以A和B的水平之和也应为140 g。因为反应![]() 物A、B的水平比为3∶4,则可将物质总水平视为7份(3+4=7),A占其中3份,B占其中4份。所以消耗B的水平为140 g÷7×4=80 g。学科text-indent:-21pt;">2.下列依据化学方程式的计算题有错误,简述错误是什么原因,并加以改正。
物A、B的水平比为3∶4,则可将物质总水平视为7份(3+4=7),A占其中3份,B占其中4份。所以消耗B的水平为140 g÷7×4=80 g。学科text-indent:-21pt;">2.下列依据化学方程式的计算题有错误,简述错误是什么原因,并加以改正。
加热12.25 g氯酸钾,充分反应后可制得氧气多少克?
解:设生成氧气的水平为x。
KClO3MnO2KCl+O2↑
122.532
12.25 g x
12.25 g=x
解得x=3.2 g![]()
答:加热12.25 g氯酸钾,可制得氧气3.2 g。
(1)错误缘由:__________________________________________________________。
(2)改正:
【答案】解:(1)化学方程式没配平。应为2KClO3MnO22![]() KCl+3O2↑
KCl+3O2↑
(2)设反应后可制得氧气的水平为x。
2KClO3MnO22KCl+3O2↑
2×122.5 3×32
12.25 gx
12.25 g=x
解得x=4.8 g
答:加热12.25 g氯酸钾,可制得氧气4.8 g。

3.用13g锌与足量的稀硫酸反应,生成的氢气的水平是__________。(锌和稀硫酸反应的化学方程式为:Zn+H2SO4==ZnSO4+H2↑)
【答案】0.4![]() g
g
【分析】
【分析】已知:锌的水平 未知:氢气的水平
解题思路:可借助二者在化学方程式(![]() 锌和硫酸反应生成硫酸锌和氢气)中的水平关系进行求解
锌和硫酸反应生成硫酸锌和氢气)中的水平关系进行求解
解题过程: 解:设生成氢气的水平为x
Zn+H2SO4===ZnSO4+H2↑
65 2
13g ![]() x
x
65:2=13g: x
x=0.4g
答:生成氢气的水平为0.4g。
4.我市某氯碱工厂排放的尾气里含有毒的氯气(Cl2),为预防其污染空气,工厂用20%的NaOH溶液吸收氯气(反应的化学方程式![]() 为Cl2+2NaOH=NaClO+NaCl+H2O).计算:4t溶质水平分数为20%的NaOH溶液,理论上可吸收氯气的水平为多少?
为Cl2+2NaOH=NaClO+NaCl+H2O).计算:4t溶质水平分数为20%的NaOH溶液,理论上可吸收氯气的水平为多少?
【答案】可吸收氯气的水平为0.71吨.
【分析】依据氯气与氢氧化钠溶液反![]() 应的化学方程式和氯气的水平,列
应的化学方程式和氯气的水平,列![]() 出比率式,就可计算出理论上可吸收氯气的水平.学.科.网
出比率式,就可计算出理论上可吸收氯气的水平.学.科.网
解:设理论上可吸收氯气的水平为x,
Cl2+2NaOH═NaCl+NaClO+H2O
71 ![]() 80
80
x 4t×20%
![]() =
=![]()
解得x=0.71t
答:理论上可吸收氯气的水平为0.71吨.
5.将6.8 g含杂质的锌粒,加入到盛有50.0 g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总水平为56.6 g。锌与硫酸反应的化学方程式为 Zn + H2SO4 = ZnSO4 + H2↑。试计算:
(1)生成氢气的水平。
(2)锌粒中所含锌的水平分数(精准到0.1%)。
【答案】解:(1)0.2g (2)95.6%
【分析】(1)依据水平守恒定律可知,反应前物质的总水平为:锌粒6.8g与50.0g稀硫酸。反应后的总水平为56.6g。水平差值6.8g+50.0g-56.6g=0.2g即为生成的氢气的水平。
(2)可依据反应中锌与氢气的水平关系求出纯净的锌的水平,再求其质![]() 量分数。解题过程:
量分数。解题过程:
解:设锌粒中含锌的水平为x 设未知量。
Zn + H2SO4 = ZnSO4 + H2↑ 写出反应的化学方程式
65 2 标出已知未知量的水平关系
X 0.2g 标出已知未知量
解得x=6.5g 求解未知量
锌粒中锌的水平分数= =95.6% 求出锌的水平分数
答:略。







