![]() 上海建青实验中学初三(上)月考化学试题
上海建青实验中学初三(上)月考化学试题
1、选择题(每题只有一个正确答案)(共30分)
1.(1分)是化学变化的是()
A.食物变质 B.冰雪融化 C.海水晒盐 D.衣服晾干
2.(1分)不是大方污染物的是()
A.NO2 B.可吸入颗粒物
C.CO2 D.SO2
3.(1分)是氧化物的是()
A.H2CO3 B.O2 C.KNO3 D.Al2O3
4.(1分)是纯净物的是()
A.果酱 B.蒸馏水 C.新鲜空气 D.矿泉水
5.(1分)加碘食盐中的“碘”是指()
A.分子 B.原子 C.元素 D.单质
6.(1分)ClO2是一种高效的消毒剂,其中氯元素的化合价是()
A.﹣1 B.﹣2 C.+2 D.+4
7.(1分)关于氧气的叙述,错误的是()
A.氧气约占空气体积的![]()
B.拉瓦锡发现了空气的组成
C.氧气是一种可燃性气体
D.氧气的化学性质比较活泼
8.(1分)在化学方程式CO2+3H2![]() R+H2O中,则R的化学式是()
R+H2O中,则R的化学式是()
A.CH4O B.CH4 C.CO D.CH2O2
9.(1分)维持氮气化学性质的微粒是()
A.氮原子 B.氮分子 C.氮元素 D.氮气
10.(1分)在20℃时,往100克饱和食盐溶液中,加入5克食盐,维持不变的是()
A.溶质水平 B.溶剂水平 C.溶液水平 D.以上皆是
11.(1分)下列操作正确的是()
A. B.
B.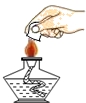
C.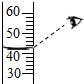 D.
D.
12.(1分)人体中某些体液的pH:血液7.35﹣7.45、胃液0.8﹣1.5、尿液5.0﹣7.0、唾液6.5﹣7.5.其中酸性最强的是()
A.血液 B.胃液 C.尿液 D.唾液
13.(1分)关于分子的叙述,正确的是()
A.所有物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不可以再分的粒子
D.分子是维持物质化学性质的一种粒子
14.(1分)是同素异形体的是()
A.CO和CO2 B.金刚石和C60
C.氧气和液氧 D.H2O和H2O2
15.(1分)关于水的净化过程描述错误的是()
A.加入明矾使小颗粒凝聚
B.通入氯气杀菌消毒
C.通过沙滤装置除去可溶性杂质
D.通过活性炭吸附部分有害物质
16.(1分)为增大二氧化碳的溶解度,可使用的办法是()
A.增加溶剂 B.升高温度并减少压强
C.降低溶剂 D.减少温度并增大压强
17.(1分)下列实验操作中,错误的是()
A.给试管里的液体加热时,试管口不可以朝着有人的方向
B.洗净的试管应倒放在试管架上晾干
C.点燃可燃性气体前,先要检验气体纯度
D.测定溶液的pH时,应先将试纸润湿
18.(1分)在H2、H2O、H2SO4三种物质中都含有()
A.2个氢原子 B.1个氢分子 C.氢元素 D.2个氢元素
19.(1分)是化合反应的是()
A.2C2H2+5O2![]() 2H2O+4CO2
2H2O+4CO2
B.CuSO4+2NaOH→Na2SO4+Cu(OH)2↓
C.2Mg+O2![]() 2MgO
2MgO
D.Zn+H2SO4→ZnSO4+H2↑
20.(1分)下列实验现象叙述正确的是()
A.木炭在氧气中燃烧,发出红光
B.硫在空气中燃烧,火焰呈蓝紫色,生成有刺激性气味的气体
C.向澄清石灰水中通入过量二氧化碳,溶液先变浑浊,后又变澄清
D.向无水硫酸铜粉末中滴加少量水,粉末由蓝色变白色
21.(1分)物质的作用与其化学性质有关的是()
A.用金刚石刻画玻璃 B.用CO冶炼金属
C.用石墨制做铅笔芯 D.用稀少气体制作霓虹灯
22.(1分)下列有关“碳循环”的说法中,不适当的是()
A.绿色植物光合用途吸收二氧化碳释放氧气
B.动物呼吸用途吸收氧气释放二氧化碳
C.用石灰水吸收空气中过量的二氧化碳,以解决温室效应
D.倡导“低碳生活”,大力推广风能、太阳能等能源
23.(1分)关于“摩尔”的说法正确的是()
A.摩尔是一个物理量
B.摩尔是物质的量的单位
C.摩尔就是物质的量
D.摩尔是表示物质水平的单位
24.(1分)有关“2H2+O2 ![]() 2H2O”的读法中,错误的是()
2H2O”的读法中,错误的是()
A.每2个氢分子和1个氧分子,在点燃的条件下反应生成2个水分子
B.氢气和氧气在点燃的条件下反应生成水
C.氢元素和氧元素在点燃的条件下反应生成水
D.每2mol氢气跟1mol氧气在点燃的条件下反应生成2mol水
25.(1分)下列混合物可以通过溶解、过滤等办法进行离别的是()
A.食盐中混有硝酸钾 B.食盐中混有泥砂
C.碳酸钙中有氧化钙 D.蒸馏水中混有酒精
26.(1分)下列混合气体,点燃时可能发生爆炸的是
①氢气和空气 ②二氧化碳和一氧化碳 ③氦气和氧气 ④天然气和氧气()
A.①② B.①②③ C.①②④ D.①④
27.(1分)下列有关CO的说法正确的是()
A.一氧化碳是有刺激性气味的有毒气体
B.在炉火上放一盆水,可以防止一氧化碳中毒
C.一氧化碳中含有氧元素和碳元素,所以它是混合物
D.一氧化碳能与血红蛋白结合,致使人体缺氧
28.(1分)下列有关能源的叙述正确的是()
A.石油是一种可再生资源
B.人类需要的能量都是由化学反应产生的
C.现在没很多氢能源,是因为氢气的制取本钱高,贮存困难
D.很多用化石能源会导致大方污染,因此应该停止化石能源的开采和借助
29.(1分)依据实验判断下列说法错误的是()

A.该固体物质的溶解度随温度的升高而增大
B.溶液b肯定是不饱和溶液
C.溶液d中溶质水平大于溶液e中的溶质水平
D.溶液d和溶液e的溶质水平分数相同
30.(1分)将肯定水平的氯酸钾与二氧化锰混合加热,变量y随加热时间的变化趋势如图,则变量y可表示的是()
A.生成O2的水平
B.固体中氧元素的水平
C.固体中MnO2的水平分数
D.固体中钾元素的水平分数
2、填空题(共46分)
31.(5分)化学使世界更美好。请用所学化学常识回答下列问题。
现有氢气、氦气、二氧化碳、食盐、甲烷、生石灰等物质,请按需要用化学式填写:
①飞艇中充入的气体是__________; ②最简单的有机物是__________
③用作干燥剂的是__________; ④用作调味品的是__________。
32.(5分)回答下列与含碳物质有关的问题
(1)石墨可以用于制作干电池电极,说明石墨能__________;
(2)制糖工业中借助活性炭的__________性脱色制白糖;
(3)CO2通入汽水中可制作碳酸饮料,反应的化学方程式__________;
(4)炼铁时发生反应:3CO+Fe2O3![]() 2Fe+3CO2,其中__________有还原性;
2Fe+3CO2,其中__________有还原性;
(5)在2Mg+CO2![]() 2MgO+C中,反应前后碳元素的存在形态由__________(填编号)。
2MgO+C中,反应前后碳元素的存在形态由__________(填编号)。
A.游离态到化合态 B.化合态到游离态
33.(5分)某患者注射用的生理盐水(含0.85~0.90%的氯化钠)中添加了适当的葡萄糖(C6H12O6)以补充能量。该注射液中的溶质为__________;葡萄糖分子中各原子物质的量之比是__________;1个葡萄糖分子中共含__________个原子;葡萄糖中水平分数最高是__________元素;0.5mol葡萄糖的水平为__________g;0.1mol 该葡萄糖中约含有__________个氧原子。
34.(9分)水是大家熟知的物质.如图1是电解水实验的示意图.
①电极上的现象是__________;b管内生成的气体是__________;
检验a管内产生气体的办法是__________.
②电解水发生化学反应的微观示意图如图2:
从示意图中可获得的正确信息是__________(填写编号).
A.水由2个氢原子和1个氧原子构成 B.反应前后元素类型不变
C.化学变化的实质是原子的重新组合 D.反应前后分子的类型没变
E.该化学反应中,生成气体的体积比是2:
1 F.水是由氢气和氧气组成
③电解水的化学方程式为__________.
④水体污染的来源主要有工业污染、农业污染和生活污水的排放等,请列举一种预防水体污染的具体做法__________.
35.(11分)依据如图所示实验,请回答有关问题:

①图A中若红磷用量不足,测得空气中氧气的体积分数将__________,红磷燃烧的化学方程式为__________;
②图B中实验运用了__________的研究办法,二氧化锰在反应前后__________均不改变,
右侧试管发生反应的化学方程式为__________;
③图C中反应后天平示数降低,有人说该反应不符合水平守恒定律.你的看法是__________;
④图D中铜片上的白磷燃烧了,热水里的白磷没燃烧,说明燃烧条件之一是__________.
⑤图E中铁丝在氧气中燃烧的现象是__________,反应的化学方程式__________;该实验瓶底放少量水或铺一层细砂的目的是__________.
36.(11分)如图是a、b、c三种物质(均不含结晶水)的溶解度曲线.
①t1℃时物质的溶解度a__________b(填“>”或“<”或“=”);
②t2℃时将28g a物质加入到50g水中充分溶解,所得溶液的水平为__________g,其中溶质与溶剂的水平比为__________;
③t1℃时,欲将c物质在m点对应的溶液变为p点的溶液,可使用的办法是__________(写一种即可);
④t2℃时,将等水平的a、b、c三种物质的饱和溶液分别降温到
t1℃时,所得溶液中的各项关系符合b>a>c的是__________(填序号).
Ⅰ.溶质水平Ⅱ.溶剂水平Ⅲ.溶液水平Ⅳ.溶质的水平分数
⑤欲配置100g水平分数为15%的a物质的溶液,所需a物质__________ g,所需蒸馏水的体积为__________ mL,可选择的量筒规格为__________ mL(填50或100),溶解时玻璃棒有哪些用途是__________.
3、简答卷(共24分)
37.(7分)为探究氧化铜与木炭反应产生气体的成分,进行如图所示实验.(B装置内药品足量)
①加热装置A,最初B中导管口冒出的气泡成分是__________,当持续加热至固体水平不再降低,A中试管内的现象是__________,反应的化学方程式为__________;B中石灰水有哪些用途__________;
②最后装置C与装置A中察看到的现象相同,说明碳与氧化铜反应还生成了__________气体.装置C内反应的化学方程式__________;③E处有哪些用途是__________.
38.(7分)依据需要回答问题.
①写出仪器名字:a__________; b__________;
②用氯酸钾和二氧化锰的混合物制取氧气可选择的装置组合是__________(填字母);
③要制取0.03mol氧气,需分解的氯酸钾的物质的量为__________;(依据化学方程式列式计算)
④现从废旧干电池中收购上述实验所需的MnO2.废旧干电池中主要含有C和MnO2(均难溶于水)、ZnCl2和NH4Cl(均易溶于水).为获得较纯的MnO2进行如下实验:

上述实验过程中,加水后用玻璃棒搅拌有哪些用途是__________;操作A的名字是__________;最后“灼烧”的目的是__________.
39.(10分)工业上用如下工艺步骤获得较纯净细白的碳酸钙用作食品添加剂,(石灰石中的杂质高温不分解、不溶于水且不与盐酸反应;氢氧化钙与盐酸反应没气泡产生)试回答:

①石灰石高温分解的化学方程式是__________;
②操作a的名字是__________,为了节省本钱,该工艺中可循环用的物质是__________;
③有同学对步骤中固体A的成分进行实验探究.
Ⅰ.提出问题:石灰石中的碳酸钙是不是完全分解了?
Ⅱ.进行猜想:①碳酸钙全部分解;②__________;③碳酸钙没分解.
Ⅲ.设计实验策略、进行实验:
下表是对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适当水溶解,静置 取少量上层清液于试管中,滴入酚酞试液; 取少量下层固体于试管中,加入足量盐酸. | 试液变为红色; __________. | 碳酸钙全部分解 |
请你对猜想②进行探究,完成下表:
实验步骤 | 实验现象 | 实验结论 |
取样,加适当水溶解,静置 取少量上层清液于试管中,滴入酚酞试液; 取少量下层固体于试管中,加入足量盐酸. |
__________. |
__________ |
上海建青实验中学初三(上)月考化学试题
参考答案与考试试题分析
1、选择题(每题只有一个正确答案)(共30分)
1.【解答】解:A、食物变质过程中有新物质生成,是化学变化。
B、冰雪融化过程中只不过状况发生改变,没新物质生成,是物理变化。
C、海水晒盐过程中没新物质生成,是物理变化。
D、衣服晾干过程中只不过状况发生改变,没新物质生成,是物理变化。
故选:A。
2.【解答】解:题中可吸入颗粒物、NO2和SO2都是空气污染物,而二氧化碳为空气的成分,不是污染物。
故选:C。
3.【解答】解:A、H2CO3中有三种元素,也含氧元素,但不是氧化物,是碱,故错。
B、氧气中只有一种元素,是单质,故错;
C、KNO3中有三种元素,也含氧元素,但不是氧化物,是碱,故错。
D、Al2O3中有两种元素,其一为氧元素,是氧化物,故正确;
故选:D。
4.【解答】解:A、果酱中含有维生素C、水等物质,是混合物,故A错;
B、蒸馏水是由水一种物质组成,是纯净物,故B正确;
C、新鲜空气中含有氧气、氮气、二氧化碳等物质,是混合物,故C错;
D、矿泉水中含有水和多种矿物质,是混合物,故D错。
故选:B。
5.【解答】解:加碘食盐中的“碘”不是以单质、分子、原子等形式存在,这里所指的“碘”是强调存在的元素,与具体形态无关。
故选:C。
6.【解答】解:依据在化合物中正负化合价代数和为零,氧元素显﹣2,设氯元素的化合价是x,可知ClO2中氯元素的化合价:x+(﹣2)×2=0,则x=+4。
故选:D。
7.【解答】解:A、氧气约占空气体积的![]() ,故A叙述正确;
,故A叙述正确;
B、拉瓦锡发现了空气的组成,故B叙述正确;
C、氧气是一种具备助燃性的气体,不具备可燃性。故C叙述错误;
D、氧气的化学性质比较活泼,故D叙述正确。
故选:C。
8.【解答】解:依据反应的化学方程式CO2+3H2![]() R+H2O和水平守恒定律可知,反应物中总共有1个碳原子、2个氧原子和6个氢原子,而生成物中只有2个氢原子和1个氧原子,还少1个碳原子、1个氧原子和4个氢原子,则每一个R分子由1个碳原子、1个氧原子和4个氢原子构成,因此R的化学式为CH4O。
R+H2O和水平守恒定律可知,反应物中总共有1个碳原子、2个氧原子和6个氢原子,而生成物中只有2个氢原子和1个氧原子,还少1个碳原子、1个氧原子和4个氢原子,则每一个R分子由1个碳原子、1个氧原子和4个氢原子构成,因此R的化学式为CH4O。
故选:A。
9.【解答】解:由于分子是维持物质化学性质的最小粒子,所以维持氮气的化学性质的最小微粒是氮分子。
故选:B。
10.【解答】解:20℃时,往100克饱和食盐溶液中,加入5克食盐,食盐不再溶解,故溶质水平不变,溶剂水平不变,溶液的组成不变,故溶液水平和溶质水平分数也不变,故选D。
11.【解答】解:A、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不可以超越试管容积的三分之一,试管与桌面大约成45°夹角,试管口不朝哪个方向自己和其他人;图中操作错误。
B、熄灭酒精灯要用灯冒盖灭,图中操作正确;
C、量取液体时,视线没与液体的凹液面最低处维持水平,图中操作错误;
D、取用液体后胶头滴管不可以倒置,以预防液体倒流,腐蚀胶头,图中操作错误。
故选:B。
12.【解答】解:A、血液的pH为7.35~7.45,大于7,显碱性。
B、胃液的pH为0.9~1.5,小于7,显酸性。
C、尿液的pH为5.0﹣7.0,小于7,显酸性。
D、唾液的pH为6.6~7.1,可能显酸性、中性或碱性。
依据当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,胃液的pH最小,酸性最强。
故选:B。
13.【解答】解:
A、构成物质的微粒有分子、原子、离子;故A不正确;
B、分子在化学变化中可以再分成原子,不是化学变化中的最小微粒;故B不正确;
C、分子是可以再分的,故C不正确;
D、分子的概念:分子是维持物质化学性质的一种微粒;故D正确。
故选:D。
14.【解答】解:判断同素异形体的重点把握两点:①同种元素形成,②不同单质。
A、一氧化碳和二氧化碳都是化合物,不是单质,不是同素异形体,故选项错误。
B、金刚石和C60都是由碳元素形成的不同物质,都是单质,互为同素异形体,故选项正确。
C、液氧是液态的氧气,与氧气是是同一种物质,不是同素异形体,故选项错误。
D、水和H2O2都是化合物,不是单质,不是同素异形体,故选项错误。
故选:B。
15.【解答】解:A、加入明矾,借助明矾溶于水形成的胶状物对杂质吸附,使杂质沉降,故选项说法正确。
B、通入氯气,能杀菌消毒,故选项说法正确。
C、沙滤装置与过滤的原理相似,可除去不溶性杂质,不可以除去可溶性杂质,故选项说法错误。
D、活性炭具备吸附性,能吸附异味和色素,能吸附部分有害物质,故选项说法正确。
故选:C。
16.【解答】解:温度越低、压强越大,气体的溶解度越大,增加或是降低溶剂的水平,不会干扰气体的溶解度,故选D。
17.【解答】解:A、给试管里的液体加热时,试管口不可以朝着有人的方向,以预防液体沸腾时喷出伤人,故选项说法正确。
B、洗干净的试管要倒扣在试管架上,故选项说法正确。
C、点燃可燃性气体前,先检验纯度再点燃,以防发生爆炸,故选项说法正确。
D、用pH试纸测定溶液的pH时,若先将试纸润湿,则致使测量不准,故选项说法错误。
故选:D。
18.【解答】解:H2、H2O、H2SO4三种化学式在这里表示的是三种物质,不表示单个的分子,物质是由元素组成的,元素只讲类型,不讲个数,
故选:C。
19.【解答】解:A、乙炔燃烧生成二氧化碳和水,该反应的反应物和生成物都是两种,不符合“多变一”的特点,不是化合反应,故选项错误。
B、该反应的反应物和生成物都是两种,不符合“多变一”的特点,不是化合反应,故选项错误。
C、镁在氧气中燃烧生成氧化镁,该反应符合“多变一”的特点,是化合反应,故选项正确。
D、该反应的反应物和生成物都是两种,不符合“多变一”的特点,不是化合反应,故选项错误。
故选:C。
20.【解答】解:A、木炭在氧气中燃烧,发出白光,故选项说法错误。
B、硫在空气中燃烧,产生淡蓝色火焰,产生一种具备刺激性气味的气体,故选项说法错误。
C、向澄清石灰水中通入过量二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,过量的二氧化碳与碳酸钙、水反应生成碳酸氢钙,会察看到溶液先变浑浊,后又变澄清,故选项说法正确。
D、向无水硫酸铜粉末中滴加少量水,粉末白色由变蓝色,故选项说法错误。
故选:C。
21.【解答】解:A、用金刚石刻画玻璃是借助金刚石的硬度大,是物理性质,故A错;
B、用CO冶炼金属是借助一氧化碳的还原性,是化学性质,故B正确;
C、用石墨制做铅笔芯是借助石墨比较软的性质,是物理性质,故C错;
D、用稀少气体制作霓虹灯是借助稀少气体通电后发出不同颜色的光,借助了物理性质,故D错。
故选:B。
22.【解答】解:
A、绿色植物的光合用途通过叶绿体借助光能把二氧化碳和水转变成储存能量的有机物并释放出氧气,故正确;
B、呼吸用途吸收氧气释放二氧化碳,故正确;
C、石灰水吸收二氧化碳的量较少,用石灰水吸收二氧化碳,需要石灰水不少,这种办法根本就不可行,故不可行;
D、调整能源结构,开发太阳能、核能、风能、水能逐步代替化石燃料,符合低碳需要,故正确。
故选:C。
23.【解答】解:摩尔是物质的量的单位,不是物理量更不是摩尔水平。
故选:B。
24.【解答】解:A、由2H2+O2![]() 2H2O可知,每2个氢分子和1个氧分子在点燃条件下发生反应,生成2个水分子。故选项正确;
2H2O可知,每2个氢分子和1个氧分子在点燃条件下发生反应,生成2个水分子。故选项正确;
B、应该是氢气和氧气在点燃条件下化合生成水。故选项正确;
C、应该是氢气和氧气在点燃条件下化合生成水。故选项错误;
D、应该是:每2mol氢气跟1mol氧气在点燃的条件下反应生成2mol水。故选项正确。
故选:C。
25.【解答】解:A、食盐和硝酸钾均易溶于水,不可以按溶解、过滤的操作顺序离别,故选项错误。
B、食盐易溶于水,而泥沙不溶于水,能按溶解、过滤等的操作顺序离别,故选项正确。
C、氧化钙和水反应生成氢氧化钙,而碳酸钙不溶于水,不可以按溶解、过滤等的操作顺序离别,故选项正确。
D、水和酒精均为液体,不可以按溶解、过滤的操作顺序离别,故选项错误。
故选:B。
26.【解答】解:①氢气具备可燃性,与空气混合遇见明火可能发生爆炸。
②一氧化碳具备可燃性,二氧化碳不可以燃烧、不可以支持燃烧,遇见明火不会发生爆炸。
③氧气能支持燃烧,氦气不具备可燃性,遇见明火不会发生爆炸。
④天然气具备可燃性,与空气混合遇见明火可能发生爆炸。
故①④点燃时可能发生爆炸。
故选:D。
27.【解答】解:A.一氧化碳有毒但没气味,故说法错误;
B.一氧化碳不溶于水,所以在炉火上放一盆水,不可以防止一氧化碳中毒,故说法错误;
C.一氧化碳中含有氧元素和碳元素,但它是化合物不是混合物,故说法错误;
D.一氧化碳的毒性表目前它能与人体血红蛋白结合,致使人体缺氧,故说法正确。
故选:D。
28.【解答】解:A、石油是不可再生的能源,错误;
B、人类需要的能量可能不是由化学反应产生的,譬如摩擦能生热,错误;
C、现在没很多氢能源,是因为氢气的制取本钱高,贮存困难,正确;
D、很多用化石能源会导致大方污染,因此应该控制化石能源的开采和借助,不可以停用,错误;
故选:C。
29.【解答】解:A、减少温度会有固体析出,故该固体物质的溶解度随温度的升高而增大,正确;
B、溶液b是溶液a升高温度得到的,故肯定是不饱和溶液,正确;
C、溶液d是饱和溶液,进行过滤后得到的e是同一温度的饱和溶液,溶质水平不变,错误;
D、溶液d是饱和溶液,进行过滤后得到的e是同一温度的饱和溶液,其溶质水平分数相同,正确;
故选:C。
30.【解答】解:氯酸钾在二氧化锰的催化用途下加热生成氯化钾和氧气,
A、生成的氧风韵量渐渐增加,然后不变,故A错误;
B、固体中的氧元素水平渐渐减小,然后不变,故B正确;
C、二氧化锰是反应的催化剂,水平不会改变,固体水平渐渐减小,固体中MnO2的水平分数渐渐增加,然后不变,故C错误;
D、固体水平渐渐减小,钾元素的水平分数渐渐增加,然后不变,故D错误。
故选:B。
2、填空题(共46分)
31.【解答】解:①氦气的密度小且化学性质不活泼,不容易的发生爆炸,故常用来充灌载人飞艇。故填:He;
②甲烷是结构最简单的有机物;故填:CH4;
③生石灰是氧化钙的俗称,能与水反应,所以可做干燥剂;故填:CaO;
④食盐是氯化钠的俗称,是常见的调味剂;故填:NaCl。
32.【解答】解:(1)石墨具备导电性,可以用于制作干电池电极;故填:导电性;
(2)活性炭具备吸附性,可以吸附色素;故填:吸附;
(3)二氧化碳与水反应生成碳酸;故填:CO2+H2O=H2CO3;
(4)在该反应中,一氧化碳夺去了氧化铁中的氧元素,将它还原为单质铁,一氧化碳具备还原性;故填:CO;
(5)在2Mg+CO2![]() 2MgO+C中,反应前碳元素存在于化合物中,在生成物存在于单质中,即由化合态到游离态;故填:B。
2MgO+C中,反应前碳元素存在于化合物中,在生成物存在于单质中,即由化合态到游离态;故填:B。
33.【解答】解:该注射液中含有氯化钠和葡萄糖两种溶质;由葡萄糖的化学式可知,一个葡萄糖分子中含有6个碳原子、12个氢原子和6个氧原子,共24个原子;原子的物质的量之比为C:H:O=1:2:
1;葡萄糖是由碳、氢、氧三种元素组成的,碳、氢、氧三种元素的水平比为:(12×6):(1×12):(16×6)=6:
1:8,可见其中氧元素的水平分数最高;葡萄糖的相对分子水平是12×6+1×12+16×6=180.则其摩尔水平为180g/mol;故0.5mol葡萄糖的水平为:
180g/mol×0.5mol=90g;1个葡萄糖分子中含有6个氧原子,则0.1mol 该葡萄糖中0.6mol氧原子,共0.6mol×6.02×1023个/mol=3.612×1023个。
故填:氯化钠和葡萄糖;C:H:O=1:2:
1;24;氧;90;3.612×1023
34.【解答】解:①电解水实验时:正氧负氢,氢二氧一,即正极产生氧气,负极产生氢气,氢气和氧气的体积比是2:
1,氧气有助燃性,氢气具备可燃性,所以电极上的现象是:产生很多气泡,b管内生成的气体是氢气,检验a管内产生气体的办法是:将带火星的木条伸到管口,缓慢打开活塞,带火星的木条复燃;
②由电解水化学反应的微观示意图可知,每一个水分子是由两个氢原子和一个氧原子构成的;水是由氢氧两种元素组成的;由微粒的变化可知,在化学变化中,分子可以再分,原子不可以再分;化学反应的实质是分子的破裂,原子的重新组合等,故选:BC;
③水在通电的条件下生成氢气和氧气,化学方程式为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
④水体污染的来源主要有工业污染、农业污染和生活污水的排放等,所以预防水体污染的具体做法是:将工业废水处置再排放.
故答案为:①产生很多气泡,氢气,将带火星的木条伸到管口,缓慢打开活塞,带火星的木条复燃;
②BC;
③2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
④将工业废水处置再排放.
35.【解答】解:①若红磷不足,就不可以把氧气完全消耗,因此结果会偏小;磷的燃烧会生成五氧化二磷,化学方程式为4P+5O2![]() 2P2O5;
2P2O5;
故填:小于 1/5; 4P+5O2![]() 2P2O5;
2P2O5;
②图B通过等体积等浓度的过氧化氢加二氧化锰可以加快反应的速率,是通过控制变量,对照实验得出结论;二氧化锰是过氧化氢分解的催化剂,因此反应前后水平与化学性质都不变;过氧化氢在二氧化锰的催化用途下生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
故填:控制变量,对照实验;水平与化学性质;2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
③装置C中将盐酸与大理石混合,反应停止后,天平不平衡,由于盐酸与碳酸钙反应生成二氧化碳气体,逸入空气,因此水平降低;
故填:符合水平守恒定律,反应后产生的气体未被称量到,所以反应后水平降低;
④通过两处白磷对比可知水中的白磷没与氧气接触,因而没燃烧,说明燃烧需用氧气;故填:燃烧需要氧气;
⑤铁丝在氧气中燃烧:察看到铁丝剧烈燃烧,火星四射,生成黑色固体,放出很多的热;燃烧产生四氧化三铁;该实验瓶底放少量水或铺一层细砂的目的是预防产生的高温熔融物使集气瓶底部炸裂;
故填:剧烈燃烧,火星四射,产生黑色固体;3Fe+2O2![]() Fe3O4;预防产生的高温熔融物使集气瓶底部炸裂.
Fe3O4;预防产生的高温熔融物使集气瓶底部炸裂.
36.【解答】解:①t1℃时物质的溶解度关系是a<b;
②t2℃时a的溶解度是50g,所以将28g加入到50g水中最多可充分溶解25g,所得溶液的水平是75g;其中溶质与溶剂的水平比为25g:50g=1::2;
③t1℃时,欲将c物质在m点对应的溶液变为p点的溶液,可使用的办法是降温结晶(或冷却热饱和溶液);
④将t2℃时a、b、c三种物质溶解度由大到小是a>b>c,温度降温到t1℃时,a、b仍为饱和溶液,且b的溶解度大于a的溶解度大于c的溶解度,C为不饱和溶液,故三种溶液的溶质水平分数大小关系 b>a>c;
⑤a的水平=100g×15%=15g;水的水平=100g﹣15g=85g;用量筒量取液体要选择与所需液体体积接近且略大的量筒,所以量取85mL水,应该选择100mL的量筒;溶解过程中玻璃棒有哪些用途为搅拌以加速溶解.
答案:
①<;②75;1:2;③加溶质或恒温蒸发溶剂;④Ⅰ、Ⅳ;⑤15;85;100;搅拌加速溶解.
3、简答卷(共24分)
37.【解答】解:①加热装置A,最初B中导管口冒出的气泡成分是空气,在高温条件下,碳与氧化铜反应生成了铜和二氧化碳,当持续加热至固体水平不再降低,A中试管内的现象是:黑色粉末变成红色固体,反应的化学方程式为:2CuO+C![]() 2Cu+CO2↑,因为二氧化碳能使澄清的石灰水变浑浊,所以B中石灰水有哪些用途是:检验并吸收反应产生的二氧化碳;
2Cu+CO2↑,因为二氧化碳能使澄清的石灰水变浑浊,所以B中石灰水有哪些用途是:检验并吸收反应产生的二氧化碳;
②最后装置C与装置A中察看到的现象相同,说明碳与氧化铜反应还生成了一氧化碳气体.一氧化碳具备还原性,在加热时能将氧化铜还原为铜,装置C内反应的化学方程式是:CO+CuO、![]() Cu+CO2;
Cu+CO2;
③因为该反应有生成的一氧化碳有毒,能污染空气,所以E处有哪些用途是:处置尾气一氧化碳,预防污染空气.
故答为①空气;(2)黑色粉末变成红色固体,2CuO+C![]() 2Cu+CO2↑,检验并吸收反应产生的二氧化碳;②一氧化碳,CO+CuO、
2Cu+CO2↑,检验并吸收反应产生的二氧化碳;②一氧化碳,CO+CuO、![]() Cu+CO2;③处置尾气一氧化碳,预防污染空气.
Cu+CO2;③处置尾气一氧化碳,预防污染空气.
38.【解答】解:①标号仪器分别是酒精灯和导管;
②加热氯酸钾和二氧化锰的混合物是固体加热型,故选发生装置A,氧气密度比空气大且不容易溶于水,所以可用向上排空气法或排水法采集;
③设需分解的氯酸钾的物质的量为x
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2 3
x 0.03mol
![]() =
=![]()
x=0.02mol
答:需分解的氯酸钾的物质的量为0.02mol;
④依据题意,该实验的目的是收购MnO2,故需除去其他物质;
ZnCl2、NH4Cl均易溶于水,所以先将混合物溶于水,溶解操作中,玻璃棒有哪些用途是加速溶解,然后进行过滤,除去可溶性的ZnCl2、NH4Cl,得到碳和二氧化锰的混合物;
C具备可燃性,故步骤c灼烧残渣的目的是除去C,得到纯净的二氧化锰;
故答案为:①酒精灯;导管;
②AC(或AE);
③设需分解的氯酸钾的物质的量为x
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2 3
x 0.03mol
![]() =
=![]()
x=0.02mol
答:需分解的氯酸钾的物质的量为0.02mol;
④加速溶解; 过滤; 除去滤渣中混有些C.
39.【解答】解:①碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②不溶于液体的固体和液体离别的一种办法是过滤,循环用的物质在前面的反应中是反应物,到了后面的反应中又成了生成物,由工艺步骤可知,固体加入试剂①变成石灰水,试剂①是水;石灰水加入试剂②得到碳酸钙和水,所以试剂②是二氧化碳,碳酸钙高温得到了氧化钙和二氧化碳,这里的二氧化碳可用于试剂②,所以可循环用,试剂①是水,最后反应又生成了水,所以水也可以循环用;
③Ⅱ、进行猜想:碳酸钙可能完全分解,可能部分分解,可能没分解,所以猜想②是碳酸钙部分分解;
III、碳酸钙和盐酸反应会生成二氧化碳,氧化钙和水会生成氢氧化钙,氢氧化钙能使酚酞变红色,所以
对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适当水溶解,静置 取少量上层清液于试管中,滴入酚酞试液; 取少量下层固体于试管中,加入足量盐酸. | 试液变为红色;没气泡产生 | 碳酸钙全部分解 |
对猜想②进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适当水溶解,静置 取少量上层清液于试管中,滴入酚酞试液; 取少量下层固体于试管中,加入足量盐酸. | 试液变为红色;有气泡产生. | 碳酸钙部分分解 |
故答案为:①CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②过滤,H2O、CO2;
③Ⅱ、进行猜想:碳酸钙部分分解;
III、对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
| 没气泡产生 |
|
对猜想②进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
| 试液变为红色,有气泡产生 | 碳酸钙部分分解 |







