![]() 5.1《日常的酸和碱》测试
5.1《日常的酸和碱》测试
1、单选题(每小题只有一个正确答案)
1.蒸馒头用到纯碱,其化学式为()
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
2.下列物质的作用,借助其物理性质的是()
A.二氧化碳制纯碱 B.熟石灰改良酸性土壤
C.金刚石切割玻璃 D.焦炭用于炼铁
3.下列物质是碱的是()
A.NaOH B.CuO C.Na2CO3 D.H2SO4
4.下列实验现象描述中,正确的是
A.将硝酸铵固体溶于水中:白色固体消失,放出热量
B.镁在空气中燃烧:发出耀眼的白光,放出热量,产生很多的白雾
C.将一氧化碳通入氧化铁中加热反应后:红棕色固体变为黑色粉末
D.打开浓硫酸的试剂瓶盖,瓶口会出现白雾
5.推理是化学学习中常见的思维办法.以下![]() 个判断正确的是( )
个判断正确的是( )
A.酸都含有氢元素,所以含有氢元素的化合物肯定是酸
B.酸与碱反应生成盐和水,所以生成盐和水的反应肯定是酸与碱的反应
C.燃烧一般都随着发光、放热现象,所以有发光、放热的现象就是燃烧
D.碱溶液中由于含有氢氧根离子而显碱性,所以显碱性的纯碱溶液中含有氢氧根离子
6.下列实验操作中,正确的是

A.A B.B C.C D.D
7.下列物质长期露置在空气中水平增大但没变质的是()
A.小苏打 B.氢氧化钠固体 C.浓盐酸 D.浓硫酸
8.对暴露在空气中部分变质的氢氧化钠溶液(以下简称样品)进行如下的四个实验,其中叙述错误的是()
A.向样品中滴入澄清石灰水,有白色沉淀生成
B.向样品中滴入足量的稀盐酸,有气体产生
C.除去样品中的杂质,可以加入过量石灰水,充分反应后再过滤
D.先向样品中加入足量CaCl2溶液,充分反应后滴加酚酞试液,上层清液变红色
9.下列有关物质性质和作用与功效的说法错误的是()
A.氮气化学性质稳定可作保护气 B.生石灰能吸收水分可作食品干燥剂
C.金刚石硬度大可作钻探机钻头 D.氢氧化钠呈碱性可用治疗胃酸过多
10.下列图像能正确反映对应变化关系的是( )
|
|
|
|
A.常温下,稀释KOH溶液 | B.将浓硫酸露置在空气中 | C.足量粉末状金属分别与等水平、等浓度的稀盐酸反应 | D.肯定水平的饱和石灰水中加入生石灰 |
A.A B.B C.C D.D
2、填空题
11.请结合图示回答下列问题:

(1)食醋有酸味,由于食醋中含有______(填化学式)。
(2)农业改良酸性土壤用的物质,其俗称有_______。(填一个)
(3)浓硫酸具备______能夺取纸张里的水分,生成黑色的炭。
(4)石灰浆粉刷墙壁变洁白和坚硬的反应________(填化学方程式)。
(5)氢氧化钠固体密封保存是什么原因_______。
(6)汽车铅蓄电池中含有些一种酸的化学式是___________。
12.久置的盛有澄清石灰水溶液的试剂瓶,其瓶塞附近总是有一层白色粉末.取该粉末于表面皿中,滴入盐酸,有气泡出现.产生气泡是什么原因这种粉末中含有(填物质名字)________ ,请写出氢氧化钙溶液变质的化学方程式________ .
13.现有六种物质:A 纯碱 B 碘酒 C 氮气 D 硝酸铵 E 盐酸 F 熟石灰.请选择相应物质的字母填空:
(1)人体胃液中的酸是______, (2)溶于水温度减少的是_______,
(3)医疗上常用做消毒_______, (4)用于改良酸性土壤的是______,
(5)侯氏联合制碱法制得的“碱”______, (6)瓜果蔬菜中的保护气是_______.
14.某农场附近新建了一座燃煤火力发电厂后该农场的小麦产量急剧降低,经农场技术员测定:雨水pH约为4,土壤pH约为5。已知一些要紧作物最适合成长的土壤的pH如下表.

依据上表数据,你觉得这种土壤比较适合种植的作物是__________。
若继续种小麦,你觉得最好使用以下__________试剂来改良土壤。
①工业用盐 ②熟石灰 ③纯碱
该区域形成酸雨的重要原因是______________________________________。
3、实验题
15.请结合图示实验装置,回答下列问题。
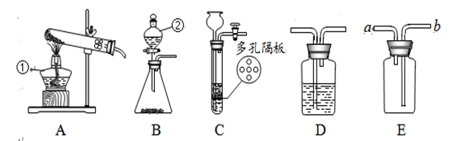
(1)请写出图中标有字母的仪器名字: ①________ ;②______。
(2)实验室用高锰酸钾制取氧气,实验时应在试管口放一团棉花,其用途是___________,反应的化学方程式是_____________。
(3)若B装置中固体为锌粒,②中加入_______试剂可制H2。要获得干燥的H2,应先将气体通过盛有_______的D装置,再用E装置采集,气体应从______ 端通入(选填“a”或“b”)。
(4)实验室用大理石和稀盐酸来制二氧化碳,C相对于B装置的优点有________________。
(5)实验室常用氯化铵固体与碱石灰固体共热来制取一种易溶于水密度比空气小的氨气(NH3),应选择的制备和发生装置是______。
16.请依据图示回答下列问题:
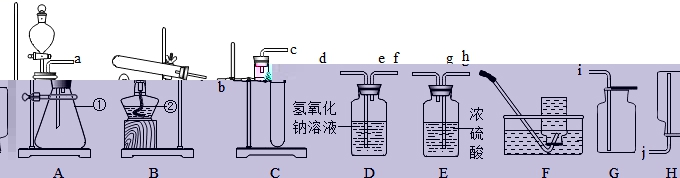
![]() 写出图中标号的仪器名字:
写出图中标号的仪器名字:![]() ______,
______,![]() ______;
______;
![]() 实验室欲用氯酸钾制取氧气,应选择的气体发生装置是______,产生氧气的化学方程式为______;
实验室欲用氯酸钾制取氧气,应选择的气体发生装置是______,产生氧气的化学方程式为______;
![]() 已知过氧化钠
已知过氧化钠![]() 是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气
是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气![]() 假如在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是
假如在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是![]() 填写管口字母
填写管口字母![]() ______
______![]() ______
______![]() ______
______![]() 若只改变A装置中的药品,仍使用已连接的整套装置,还可以用来制取的气体是______.
若只改变A装置中的药品,仍使用已连接的整套装置,还可以用来制取的气体是______.
![]() 通过上述两种制取氧气的办法所使用发生装置的对比,你感觉选择气体发生装置应考虑的原因是______和______;
通过上述两种制取氧气的办法所使用发生装置的对比,你感觉选择气体发生装置应考虑的原因是______和______;
![]() 装置A和C都可以作为实验室制取同种气体的发生装置,A和C相比,具备什么优点?
装置A和C都可以作为实验室制取同种气体的发生装置,A和C相比,具备什么优点?![]() 只答出一条即可
只答出一条即可![]() ______.
______.
4、判断题
17.已知A~H八种物质均为初中化学容易见到物质,A、B、E、F为不相同种类别的化合物,B、D、G为氧化物,B为常用食品干燥剂,D在常温下为液态,E为常用洗涤剂,G、H为无色气体。F为胃酸的主要成分。A、B、E放入水中能使酚酞变红,下图是它们之间的关系 ,请回答:

写出下列物质的化学式:B是______;F是_______。
固态物质A的俗名为________。
写出B与D反应的化学方程式___________,此反应是_____反应。B和D的反应_______。
写出G→H的化学反应方程式__________________。
18.A、B、C、D、E、F、H、I、M为容易见到的物质,且有如下的转化关系.已知A、B是由相同元素组成的无色液体,D为氧化钙(CaO)与B化合可得到F,E为黑色固体,在C中燃烧发出白光,反应②是实验室检验气体H的反应.请回答:

(1)写出E、H、I三种物质名字(或化学式):
E为__________,H为__________,I为___________。
(2)在上述反应中M有哪些用途是 _____________。
(3)请用文字表达式(或符号)下列化学反应:
a.A→B的化学反应 ______________________________________
b.②的化学反应__________________________________________
5、计算题
19.实验室用10克8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:

A点溶液的溶质___________。
计算所用的该稀硫酸的水平分数_______?
假如配制100克该稀硫酸所用图中浓硫酸的水平为10克,则图中盛浓硫酸试剂瓶上的标签的溶质水平分数应填上___________%。
图中的浓硫酸多次用后,发现浓度变小了,缘由是___________________。
20.为测定某敞口放置的氢氧化钠溶液的变质状况,某同学实验并记录如图:

(1)配制实验步骤1所用的稀盐酸,需要水平分数为36.5%的浓盐酸的水平是__________;
(2)B烧杯中发生反应的化学方程式为__________;
(3)依据已知条件求样品溶液中碳酸钠水平是多少?
(4)依据计算得知D烧杯溶液中溶质的化学式为__________。
参考答案
1.B
【分析】
考试试题剖析:蒸馒头用到纯碱,其化学式为Na2CO3。A是氢氧化钠,C是碳酸氢钠,D是氯化钠。故选B.
考试知识点:化学式
2.C
【分析】A. 二氧化碳制纯碱是借助二氧化碳的化学性质,不符合题意;B. 熟石灰改良酸性土壤,是借助中和原理,不符合题意;![]() C. 金刚石切割玻璃,借助金刚石硬度大的物理性质,符合题意;
C. 金刚石切割玻璃,借助金刚石硬度大的物理性质,符合题意;![]() D. 焦炭用于炼铁,是借助焦炭的还原性,不符合题意。故选C。
D. 焦炭用于炼铁,是借助焦炭的还原性,不符合题意。故选C。
3.A
【分析】
【解析】
A、氢氧化钠是由钠离子和氢氧根离子组成的化合物,是碱,故选项正确;
B、CuO是由铜、氧两种元素组成的化合物,是氧化物,故选项错误;
C、碳酸钠是由钠离子和碳酸根离子组成的化合物,是盐,故选项错误;
D、H2SO4是由氢离子和硫酸根离子构成的化合物,是酸,故选项错误。
故选A。
4.C
【分析】A、将硝酸铵固体溶于水中要吸收热量,错误;B、镁在空气中燃烧发出耀眼的白光,放出热量,生成一种白色固体,错误;C、一氧化碳还原氧化铁,红棕色粉末渐渐变成黑色,正确;D、浓硫酸具备吸水性,打开装有浓硫酸的试剂瓶盖,瓶口没有明显变化,错误。故选C。
5.D
【分析】
【解析】
A、酸都含有氢元素,但含有氢元素的化合物可能不是酸,电离出来的阳离子全部是氢离子的化合物才是酸,比如碳酸氢钠含有氢元素,但不是酸而是盐,故A不正确;B、酸与碱反应生成盐和水,金属氧化物和酸反应也生成盐和水,非金属氧化物与碱反应也生成盐和水,故B是不对的;C、有发光、放热的现象可能不是燃烧,比如灯泡发光放热,是物理变化,根本不是燃烧,故C是不对的;D、电离出来的阴离子全部是氢氧根离子的化合物是碱,所以碱溶液中由于含有氢氧根离子而显碱性,显碱性的纯碱溶液中也含有氢氧根离子,所以才显碱性,故D是正确的。故选D。
6.C
【分析】A、胶头滴管的用法应该注意,滴加液体时不可以伸入容器内部,以免污染试剂,用完将来也不可以横放或倒置以免腐蚀橡胶帽,错误;B、稀释浓硫酸时应将浓硫酸慢慢的注入水中,并持续的搅拌,不可以将水注入浓硫酸中,不然会致使液体飞溅而发生危险,错误;C、检查装置气密性的办法是“一浸二握三看”,即先把导气管的一端浸入水中,然后用手握住试管,看导气管的一端是不是有气泡产生,若有则表示装置的气密性好,正确;D、熄灭酒精灯应用灯帽盖灭,错误。故选C。
7.D
【分析】
【解析】
A、小苏打是碳酸氢钠,不具备吸水性,也不与空气中的物质反应,故长期露置在空气中水平不会增加,故错误;
B、氢氧化钠易潮解,易吸收空气中的水分,也可以与空气中的二氧化碳反应使氢氧化钠变质,故错误;
C、浓盐酸易挥发,长期露置在空气中水平降低,故错误;
D、浓硫酸具备吸水性,不与空气中的物质反应,故长期露置在空气中水平增加,没变质,故正确。故选D。
8.C
【分析】氢氧化钠易与空气中的二氧化碳反应生成碳酸钠而变质。A、向样品中滴入澄清石灰水,氢氧化钙与碳酸钠反应生成碳酸钙沉淀,正确;B、向样品中滴入足量的稀盐酸,稀盐酸与碳酸钠反应生成二氧化碳气体,正确;C、除去氢氧化钠中的碳酸钠,若加入过量的澄清石灰水会带入新的杂质,错误;D、向样品中加入足量CaCl2溶液,充分反应后滴加酚酞试液,因为氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,氯化钠和氯化钙均呈中性,若上层清液变成红色说明溶液呈碱性,说明含有氢氧化钠,正确。故选C。
9.D
【分析】A、氮气的化学性质稳定可作保护气,正确;
B、生石灰可以与水反应,故可以做食品干燥剂,正确;
C、金刚石是天然最硬的物质,故可以做钻头,正确;
D、氢氧化钠是强碱性物质,有强烈的腐蚀性,不可以用于治疗胃酸过多,错误。故选D。
10.C
【分析】A稀释氢氧化钾的过程中,碱性溶液溶度变小,溶液的pH变小,但因为溶液一直呈碱性,所以pH不会等于7,更不会小于7;B浓硫酸有吸水性,敞口放置时,溶质不变,溶剂增多,溶质的水平分数变小,但因为溶质的水平大于零,所以溶质的水平分数应一直大于零;C.足量粉末状金属,保证酸完全反应,最后由酸决定氢气的多少,因为酸相同,最后生成氢风韵量相同;镁的活动性比锌强,所以镁反应更快,先反应完;D饱和石灰水中不再溶解氢氧化钙,溶质不会增多;氧化钙和水反应,使饱和石灰水 的溶剂降低,溶质析出,溶液水平降低,水被完全反应后溶质、溶剂、溶液的水平都为零。选C
点睛:图像的问题主如果结合化学反应剖析图的起点的地方,变化趋势,终点的地方是不是正确
11.CH3COOH 熟石灰或消石灰 (强烈的)腐蚀性(或脱水用途或脱水性) Ca2+CO2=CaCO3↓+H2O 氢氧化钠固体易吸水潮解,易跟空气中二氧化碳反应变质 H2SO4
【分析】
【解析】
(1)食醋有酸味,由于食醋中含有醋酸,化学式为CH3COOH;
(2)农业改良酸性土壤用的物质氢氧化钙,俗称为熟石灰或消石灰;
(3)浓硫酸具备强烈的脱水性,能夺取纸张里的水分,生成黑色的炭;
(4)石灰浆粉刷墙壁变洁白和坚硬的原理是氢氧化钙和空气中二氧化碳反应生成碳酸钙和水,反应的化学方程式为Ca2+CO2=CaCO3↓+H2O;
(5)氢氧化钠固体密封保存是什么原因氢氧化钠固体易吸水潮解,易跟空气中二氧化碳反应变质;
(6)汽车铅蓄电池中含有些一种酸是稀硫酸,其化学式为H2SO4。
12.碳酸钙;Ca(OH)2+CO2═CaCO3↓+H2O
【分析】
【解析】
久置的盛有澄清石灰水溶液的试剂瓶,其瓶塞附近总是有一层白色粉末,这是由于石灰水吸收了空气中的二氧化碳,并且反应生成碳酸钙的原故;氢氧化钙和二氧化碳反应的化学方程式为:Ca2+CO2═CaCO3↓+H2O。
【点睛】
石灰水可以吸收空气中的二氧化碳,其中的氢氧化钙能和二氧化碳反应生成碳酸钙沉淀和水。
13.E; D; B; F; A; C.
【分析】
【解析】
(1)人体胃液中的酸是盐酸,故填E;
(2)溶于水温度减少的是硝酸铵,故填D;
(3)医疗上常用做消毒的是碘酒,故填B;
(4)用于改良酸性土壤的是熟石灰,故填F;
(5)侯氏联合制碱法制得的“碱”是纯碱,故填A;
(6)瓜果蔬菜中的保护气是化学性质比较稳定的氮气,故填C。
14. ⑤ ② 含硫煤燃烧生成的SO2放到空气中
【分析】(1)土壤的PH为5,在4.8—5.5之间,故可种植马铃薯⑤;(2)小麦适合的土壤PH为6.3—7.5,改良酸性土壤用熟石灰,故选②;(3)该区域形成酸雨主如果由于电厂含硫煤燃烧生成的SO2放到空气中而形成的。
15.酒精灯 分液漏斗 预防高锰酸钾进入导管 2KMnO4![]() K2MnO4+MnO2+O2↑ 稀硫酸 浓硫酸 a 能使反应随时进行或停止 AE
K2MnO4+MnO2+O2↑ 稀硫酸 浓硫酸 a 能使反应随时进行或停止 AE
【分析】
【解析】
(1)①的仪器名字是酒精灯;②的仪器名字是分液漏斗;
(2)实验室用高锰酸钾制取氧气,实验时应在试管口放一团棉花,其用途是预防高锰酸钾进入导管,高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)锌与稀硫酸反应生成硫酸锌和氢气。若B装置中固体为锌粒,②中加入稀硫酸试剂可制H2;浓硫酸具备吸水性。要获得干燥的H2,应先将气体通过盛有浓硫酸的D装置;氢气密度比空气小,若用E装置采集,因为气体应从a 端通;
(4)实验室用大理石和稀盐酸来制二氧化碳,用装置C时,固体(碳酸钙)放在多孔隔板上,液体药品(稀盐酸)从长颈漏斗中加入。反应开始后,关闭开关,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体离别,反应停止,再打开开关时,气体导出,试管中的气体降低,压强减小,液体和固体混合,反应进行。实验室用装置C代替装置B制取气体,装置C的优点是能使反应随时进行或停止;
(5)依据“实验室常用氯化铵固体与碱石灰固体共热来制取一种易溶于水密度比空气小的氨气(NH3)”可知,该反应的反应物是固体,反应条件是加热,可使用发生装置A,氨气易溶于水,不可以用排水法采集,密度比空气小,可以用向下排空气法采集,即用E装置采集。所以实验室常用氯化铵固体与碱石灰固体共热来制取一种易溶于水密度比空气小的氨气(NH3),应选择的制备和发生装置是AE。
【点睛】
气体的制取装置的选择与反应物的状况和反应的条件有关;气体的采集装置的选择与气体的密度和溶解性有关。
16.锥形瓶 酒精灯 B 2KClO3![]() 2KCl + 3O2 ↑ g f i 二氧化碳 反应物状况 反应条件 可以控制反应速率
2KCl + 3O2 ↑ g f i 二氧化碳 反应物状况 反应条件 可以控制反应速率
【分析】
【解析】
(1)标号①的仪器名字是锥形瓶,标号②的仪器名字是是酒精灯;
(2)实验室用氯酸钾制取氧气,反应物的状况是固体,反应条件是加热,应选择的气体发生装置是B;氯酸钾在二氧化锰的催化用途下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl + 3O2 ↑;
2KCl + 3O2 ↑;
(3)浓硫酸的吸水性,洗气时为了使气体与浓硫酸充分接触,气体是长管进短管出,氧气的密度大于空气,可用向上排空气法采集,制出的气体经过洗气之后采集干燥的氧气,要用G装置采集,所以正确连接顺序是为:g→f→i;实验室用碳酸钙和稀盐酸制二氧化碳气体,反应物状况是固体与液体,无需加热可用使用发生装置A,二氧化碳也会混有水蒸气,得到干燥的二氧化碳气体也需要干燥和向上排空气法采集,若只改变A装置中的药品,仍使用已连接的整套装置,还可以用来制取的气体是二氧化碳;
(4)A没用酒精灯加热,用的是锥形瓶和分液漏斗,反应物状况是固体与液体,无需加热是固—液反应不需要加热型;B用到酒精灯加热,且试管口向下倾斜,反应物的状况是固体,反应条件是加热,是固体加热型,所以选择气体发生装置应考虑的原因为:反应物状况和反应条件;
(5)A装置中的分液漏斗,可以通过开关控制液体的滴加及滴加快慢,从而能控制反应速率,C装置只不过一个导管和试管。A和C相比,A可以控制反应速率。
17. CaO HCl 熟石灰或消石灰 CaO+H2O===Ca2 化合 放热 6CO2+6H2O====C6H12O6+6O2
【分析】(1)F为胃酸的主要成分,故F是HCl,B为常用食品干燥剂,且是氧化物,故B是氧化钙,化学式为CaO,氧化钙能生成A ,且将A放入水中溶液显降低,故A 是氢氧化钙,D在常温下为液态,且是氧化物,故D是水,E为常用洗涤剂,故E是碳酸钠,碳酸钠与F能生成气体G ,故G是二氧化碳,二氧化碳和水都能生成H,故H是氧气。
(2)固态A是熟石灰;
(3)氧化钙与水反应生成氢氧化钙,反应方程式为CaO+H2O===Ca2。该反应是强放热反应;
(4)二氧化碳经光合用途可以生成氧气,反应方程式为6CO2+6H2O====C6H12O6+6O2
18.CCO2CaCO3催化用途H2O2 ![]() H2O + O2CO2 + Ca2
H2O + O2CO2 + Ca2 ![]() CaCO3 + H2O
CaCO3 + H2O
【分析】
【解析】
已知A、B是由相同元素组成的无色液体,A能转化成B,过氧化氢在二氧化锰有哪些用途下分解生成水和氧气,所以A为过氧化氢,B为水,C为氧气;氧化钙(CaO)与水化合可得到氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,用于二氧化碳的检验,故F是氢氧化钙,D为氧化钙(CaO),I为碳酸钙;E为黑色固体,在氧气中燃烧发出白光,故E为碳,反应②是实验室检验气体二氧化碳的反应即为氢氧化钙和二氧化碳的反应,H为二氧化碳。(1)E、H、I三种物质名字(或化学式):E为碳,化学式为C;H为二氧化碳,化学式为CO2;I为碳酸钙,化学式为CaCO3;
(2)二氧化锰是过氧化氢分解的催化剂,在反应中二氧化锰有哪些用途是催化用途;
(3)符号表达式的书写办法:在箭头的左侧写出反应物的符号,在箭头的右侧写出生成物的符号,箭头的上方标出反应条件。a.A→B的化学反应:H2O2![]() H2O + O2;b.②的化学反应:CO2+ Ca2
H2O + O2;b.②的化学反应:CO2+ Ca2 ![]() CaCO3 + H2O。
CaCO3 + H2O。
【点睛】
要想顺利解决判断题,就要熟练学会物质的特征、作用与功效,即常发生的化学反应,甚至反应条件。如;反应条件高温的初中就两类反应:碳酸钙高温分解,金属氧化物被还原。蓝色的溶液肯定是含铜离子等。
19. Na2SO4,H2SO4 9.8% 98% 浓硫酸吸收了空气中水份
【分析】 氢氧化钠溶液和稀硫酸反应生成硫酸钠和水,A点呈酸性,说明硫酸过量,故溶质为Na2SO4和H2SO4; 设参加反应的H2SO4水平![]()
2NaOH + H2SO4 =Na2SO4 +2H2O
80 98
10g×8% ![]()
![]() ×8%=
×8%=![]()
H2SO4%=![]() ×100%=9.8% 答:所用的该稀硫酸的水平分数为9.8%。
×100%=9.8% 答:所用的该稀硫酸的水平分数为9.8%。
配制100克该稀硫酸所用浓硫酸的水平为10克,设所用浓硫酸的水平分数为y
100g×9.8%=98% y y= 98% 浓硫酸有吸水性,吸收了空气中水而被稀释,致使溶质的水平分数变小。
20.(1)10g;(2)NaOH+HCl==NaCl+H2O;(3)21.2g;(4)NaCl、Na2CO3、NaOH
【分析】步骤1所用的稀盐酸为50g7.3%,依据稀释定律,需要水平分数为36.5%的浓盐酸的水平是![]() =10g;
=10g;
B烧杯中加入盐酸后无气泡产生,溶液仍然是红色,所以发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
生成二氧化碳的水平为50g+200g-245.6g=4.4g,
设C烧杯溶液中碳酸钠水平为x,参加反应的HCl为y;
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y 4.4g![]() =
=![]() =
=![]() 解得:x=10.6g,y=7.3g;则原样品溶液中碳酸钠水平是10.6g×2=21.2g;
解得:x=10.6g,y=7.3g;则原样品溶液中碳酸钠水平是10.6g×2=21.2g;
实验步骤1中参加反应的HCl的水平为50g×7.3%=3.65g,步骤2中实质提供的HCl为200g×7.3%=14.6g,说明与NaOH反应的HCl为14.6g-7.3g=7.3g,由此可知步骤1中加入的50g稀盐酸没反应将溶液中的氢氧化钠完全中和,即仍有NaOH未反应,所以D烧杯溶液中所含溶质的化学式为NaCl、NaOH、Na2CO3。
点睛:本题两个主要难题,稀释定律的应用,即浓溶液稀释前后溶质不变;借助化学方程式计算,判断D烧杯反应后溶液中所含溶质的化学式,易错点是已经明确步骤1滴加的稀盐酸是中和溶液中的NaOH,而直接判断反应后D中没NaOH,事实通过步骤2的计算可知,步骤1中滴加的稀盐酸并没完全中和NaOH,因此依据实验原理,结合数据处置,依据事实判断是解题重点。










