第五单元 化学方程式 单元测试题2
(时间:60分钟 满分:100分)
学校:___________ 名字:__________ 班级:__________ 得分:
1、单选题(13个小题,每小题5分,共65分)
1.下列化学方程式书写正确的是()
A.镁在空气中燃烧:Mg+O2 ![]() MgO2
MgO2
B.氢氧化钠溶液在空气中变质:NaOH+CO2═Na2CO3+H2O
C.硫酸的制备:Na2SO4+2HCl═2![]() NaCl+H2SO4
NaCl+H2SO4
D.氧化汞受热分解:2HgO ![]() 2Hg+O2↑
2Hg+O2↑
【答案】D
【分析】A、该化学方程式氧化镁的化学式书写错误,正确的化学方程式应为2Mg+O2![]() 2MgO,故A错误;B、该化学方程式没配平,正确的化学方程式应为2NaOH+CO2═Na2CO3+H2O,故B;C、硫酸钠与盐酸交换成分没沉淀、气体或水生成,不可以发生复分解反应,故选项错误;D、该化学方程式书写完全正确。故选D。
2MgO,故A错误;B、该化学方程式没配平,正确的化学方程式应为2NaOH+CO2═Na2CO3+H2O,故B;C、硫酸钠与盐酸交换成分没沉淀、气体或水生成,不可以发生复分解反应,故选项错误;D、该化学方程式书写完全正确。故选D。
2.高氯酸按是一种火箭推进剂,当它发生分解反应时。不可以生成的物质是
A.O2 B.N2 C.Cl2 D.CO2
【答案】D
【![]() 分析】由水平守恒定律:化学反应前后元素不变;高氯酸铵的化学式NH4ClO4,该物质由N、H、O、Cl四种元素组成,其组成中不含C元素;依据化学变化前后元素类型不变,而分解反应的反应物只有一种,则可判断高氯酸铵分解不可能产生由C、O元素组成的CO2。故选D。
分析】由水平守恒定律:化学反应前后元素不变;高氯酸铵的化学式NH4ClO4,该物质由N、H、O、Cl四种元素组成,其组成中不含C元素;依据化学变化前后元素类型不变,而分解反应的反应物只有一种,则可判断高氯酸铵分解不可能产生由C、O元素组成的CO2。故选D。
3.在一个密闭容器中放入X、Y、Z、W四种物质,在肯定条件下发生化学反应,一段时间后,测得有关![]() 数据如下表。下列关于此反应的认识正确的是
数据如下表。下列关于此反应的认识正确的是
物 质 | X | Y | Z | W |
反应前的水平/g | 20 | m | 16 | 14 |
反应后的水平/g | 4 | 6 | 60 | 50 |
A.参加反应的X与Y的水平比为1︰4
B.若W为水,则X或Y一定为酸或碱
C.m的数值为64
D.若X为化合物,Y为单质,则该反应肯定为置换反应
【答案】A
【分析】由表中数据剖析可知,反应前后X的水平降低了20g-4g=16g,故X是反应物,参加反应的X的水平为16g;同理可以确定Z是生成物,生成的Z的水平为60g-16g=44g;W是生成物,生成的W的水平为50g-14g=36g;A、参加反应的X与Y的水平比为16g:64g=1:4,故选项说法正确;B、该反应的反应物为X和Y,生成物是W和Z,若W为水,因为没办法确定X、Y的元素组成,X或Y未必为酸或碱,如甲烷燃烧也能生成水,但反应物不是酸或碱,故选项说法错误;C、由水平守恒定律,Y应是反应物,且参加反应的Y的水平为44g+36g-16g=64g,故m的数值为6g+64g=70g,故选项说法错误;D、若X为化合物,Y为单质,生成物可能均为化合物,则该反应未必为置换反应,如甲烷燃烧生成二氧化碳![]() 和水,故选项说法错误。故选:C。
和水,故选项说法错误。故选:C。
4.下列关于化学变化的说法,不正确的是
A.分子肯定发生变化 B.原子核肯定不发生变化
C.元素的类型可能发生变化 D.元素的化合价未必发生变化
【分析】化学变化是指变化时生成了其他物质的变化。A、分子肯定发生变化,化学变化的实质是分子的划分,原子的重新组合,故A正确;B、原子核肯定不发生变化,原子是化学变化中的最小微粒,故B正确;C、元素的类型可能发生变化,化学变化只不过原子的重新组合,元素类型没发生变化,故C错误;D、元素的化合价未必发生变化,只有那些氧化还原反应反应,才会有化合价的变化,故D正确。
5.下列说法正确的是 ( )
A.反应前后物质的水平守恒、体积守恒、分子数目守恒
B.反应物的水平总和等于生成物的水平总和
C.反应后生成新物质不是新元素 D.反应前后分子类型、原![]() 子类型都没变
子类型都没变
【答案】C
【分析】A.反应前后物质的总水平守恒、原子数目守恒,分子数目不确定,错误;B.参加反应的各物质的水平总和等于反应后生成的各物质的水平总和,错误;C.反应前后原子的类型不变,所以元素的不变,所以化学反应不会生成新元素,正确;D.反应前后分子类型改变、原子类型不变,错误。故选C。
6.下图中四位同学正在讨论某一化学方程式表示的意义,他们所描述的化学方程式是( )
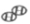
A![]() .S + O2点燃SO2 B.2CO+O2 点燃2CO2
.S + O2点燃SO2 B.2CO+O2 点燃2CO2
C.2H2+O2点燃2H2O D.CH4+2O2点燃CO2+2H2O
【答案】C
【分析】化学方程式中的化学计量数之比等于分子个数比;物质的水平比等于化学计量数和相对分子水平乘积的比,A.S + O2__________SO2分子个数比为1:1:1,错误;B.2CO+O2 __________2CO2,分子个数比为2:1:2,物质的水平比56:32:88=7:4:11,错误;C.2H2+O2__________2H2O,分子个数比为1:1:1,物质的水平比为4:32:36=1:8:9,正确;D.CH4+2O2__________CO2+2H2O,分子个数比为1:2:1:2,错误。故选C。
7.某反应:2X +O2→2SO3,X的化学式为
A.S B.SO3 C.H2SO3 D.SO2
【答案】D
【分析】据水平守恒定律可知,化学反应前后原子的类型、个数不变,反应前有2个氧原子,反应后有2个硫原子、 6个氧原子,所以一个X的分子中有2个氧原子、1个硫原子;X的化学式为SO2。故选D。
8.下列各项:①原子的数目;②分子的数目;③元素的类型;④物质的类型;⑤物质的分子个数;⑥各种原子的总数;⑦反应物和生成物的总水平。在化学反应前后,一定没变化的是
A.①③⑥⑦ B.①⑥ C.②③⑤ D.①③⑥
【答案】A
【分析】反应前后:①原子的数目肯定不变;②分子的数目可能改变,也会不变;③元素的类型肯定不变;④物质的类型肯定改变;⑤物质的分子个数肯定改变;⑥各种原子的总数肯定不变;⑦反应物和生成物的总水平肯定不变。故选A。
9.在化学反应3H2+Fe2O3![]() 2F+3H2O中,反应中各物质之间的水平比是
2F+3H2O中,反应中各物质之间的水平比是
A.1∶1 B.3∶12∶3 C.3∶80∶56∶27 D.1∶80∶28∶9
【答案】C
【分析】反应中各物质之间的水平比是:(3×2):160:(2×56):(3×18)![]() =3∶80∶56∶27,故选C。
=3∶80∶56∶27,故选C。
10.对于甲烷燃烧的化学方程式CH4+2O2 ![]() CO2+2H2O,下列理解错误的是( )
CO2+2H2O,下列理解错误的是( )
A.甲烷和氧气在点燃的条件下反应生成二氧化碳和水
B.反应过程中甲烷、氧气、二氧化碳和水的分子个数之比为1:2:1:2
C.若1个甲烷分子和2个氧气分子反应可生成1个二氧化碳分子和2个水分子
D.若16g甲烷和32g氧气反应可生成44g二氧化碳和18g水
【答案】D
【分析】A、甲烷和氧气在点燃的条件下反应生成二氧化碳和水,是化学方程式的宏观描述,正确;B、由化学方程式的系数可知,参加反应的甲烷和氧气与反应生成的二氧化碳和水的分子个数之比为1:2:1:2,正确;C、1个甲烷分子和2个氧气分子反应生成1个二氧化碳分子和2个水分子,符合反应时微观粒子个数比是1:2:1:2,正确;D、由方程式的水平关系可知,在点燃的条件下,16g甲烷和64g氧气反应生成44g二氧化碳和36g水,错误。故选D。
11.下列化学方程式的书写正确的是( )
A.Mg + O2 = MgO B.4Fe + 3O2 = 2Fe2O3
C.2KMnO4 = K2MnO4 + MnO2 + O2↑ ![]() D.CO2 + Ca2 = CaCO3↓+ H2O
D.CO2 + Ca2 = CaCO3↓+ H2O
【答案】D
【分析】A、2Mg+O2 = 2MgO,故A错误;B、3Fe + 2O2 ![]() Fe3O4,故B错误;C、2KMnO4
Fe3O4,故B错误;C、2KMnO4![]() K2MnO4 + MnO2 + O2↑,故C错误;D、CO2 + Ca2 = CaCO3↓+ H2O,故D正确。
K2MnO4 + MnO2 + O2↑,故C错误;D、CO2 + Ca2 = CaCO3↓+ H2O,故D正确。
12.已知某反应A+B = C + D,若15gA和10gB恰好![]() 完全反应生成5gC,则12gA和10gB反应能生成D为( )
完全反应生成5gC,则12gA和10gB反应能生成D为( )
A.2.5g B.5g C.16g D.10g
【答案】C
【分析】据水平守恒定律可知,反应前后物质的总水平不变,若15gA和10gB恰好完全反应生成5gC,则生成D的水平为15g+10g-5g=20g,由此可知,A和D的水平比为15:20=3:4,12gA和10gB反应时,B过量,所以应由A、D的水平比计算能生成D的水平,设生成D的水平为x,则3:4=12g:x,x=16g,故选C。
13.铜绿受热分解生成氧化铜、水和二氧化碳,则铜绿中含有些元素有( )
A.氢元素和铜元素 B.氧元素和铜元素
C.氢元素、铜元素、氧元素和碳元素 D.不可以确![]() 定
定
【答案】C
【分析】据水平守恒定律可知,反应前后元素的类型不变。氧化铜、水和二氧化碳三种物质中有氧、碳、氢、氧四种元素,而反应前只有铜绿一种物质,所以铜绿中有氧、碳、氢、氧四种元素。故选C。
2、非选择题(本题包含3个小题,共35分)
14.依据下列反应事实写出相应的化学方程式。
(1)实验室用锌和稀硫酸反应制取氢气,同时生成硫酸锌: __________________。
(2)木炭不完全燃烧生成一种有毒气体: _____________________________。
(3)少量FeCl3溶液滴入NaOH稀溶液中生成Fe3沉淀和NaCl溶液: __________________。
(4)用一氧化碳和磁铁矿(主要成分为Fe3O4)高温炼铁: ___________________。
(5)碱式碳酸铜受热分解生成三种氧化物: ______________________。
【答案】 Zn+H2SO4═ZnSO4+H2↑ 2C+O2![]() 2CO FeCl3+3NaOH=Fe3
2CO FeCl3+3NaOH=Fe3![]() +3NaCl Fe3O4+4CO
+3NaCl Fe3O4+4CO![]() 3Fe+4CO2 Cu22CO3
3Fe+4CO2 Cu22CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
【分析】(1)锌和硫酸反应生成硫酸锌和氢气,反应的化学方程式:Zn+H2SO4═ZnSO4+H2↑;(2)木炭不完全燃烧生成一氧化碳,反应的化学方程式:2C+O2![]() 2CO;(3)FeCl3和NaOH生成Fe3沉淀和NaCl,反应的化学方程式:FeCl3+3NaOH=Fe3
2CO;(3)FeCl3和NaOH生成Fe3沉淀和NaCl,反应的化学方程式:FeCl3+3NaOH=Fe3![]() +3NaCl;(4)一氧化碳和Fe3O4在高温下生成铁和二氧化碳,反应的化学方程式:Fe3O4+4CO
+3NaCl;(4)一氧化碳和Fe3O4在高温下生成铁和二氧化碳,反应的化学方程式:Fe3O4+4CO![]() 3Fe+4CO2;(5)碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,反应的化学方程式:Cu22CO3
3Fe+4CO2;(5)碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,反应的化学方程式:Cu22CO3![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
15.下图![]() 是氢气和氧气发生反应的微观模拟图,请回答下列问题:
是氢气和氧气发生反应的微观模拟图,请回答下列问题:
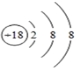
(1)在B图中将有关粒子图形补充完整;____________
(2)A图所示物质是____________(填物质分类),从微观角度说明理由___________
(3)画出一个具备相对稳定结构的原子结构示意图___________________。
【答案】 ![]() 、
、![]() 混合物 由两种分子构成
混合物 由两种分子构成 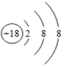
【分析】(1)据水平守恒定律可知,反应前后原子的类型、个数不变,氢气燃烧时,每两个氢分子和一个氧分子结合生成两个水分子;在B图中应补充一个![]() 和一个
和一个![]() ;(2)A图所示物质由两种物质组成,是混合物,微观角度的原因是:物质由两
;(2)A图所示物质由两种物质组成,是混合物,微观角度的原因是:物质由两![]() 种分子构成;(3)在原子结构示意图中,小圆圈表示原子核,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构;如:
种分子构成;(3)在原子结构示意图中,小圆圈表示原子核,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构;如: 。
。
16、实验室加热氯酸钾和二氧化锰的混合物28g制取氧气,完全反应后剩余固体水平为18.4g,请计算:
(1)生成氧气的水平;
(2)原混合物中氯酸钾的水平。
【答案】(1)9.6g(2)24.5g
【分析】

2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
X 9.6g
![]() x=24.5g
x=24.5g
答:生成氧气的水平为9.6g,原混合物中氯酸钾的水平为24.5g。







