初中三年级化学要点汇总
1、化学变化和物理变化的根本不同是:有没新物质的生成。化学变化中随着发生一些如放热、发光、变色、放出气体、生成沉淀等现象。
物理变化:稀少气体充作霓虹灯、气球爆炸、![]() 充作气球、干冰升华,
充作气球、干冰升华,![]() 潮解等;
潮解等;
化学变化:氮气用作保护气、![]() 具备可燃性、
具备可燃性、![]() 变质、食物腐败等。
变质、食物腐败等。
纯净物:由同一物质组成;例:冰水混合物、胆矾等。
混合物:由两种或两种以上的物质组成。例:石灰石、天然气、空气等。
3、单质:由同种元素组成的纯净物;
化合物:由不同种元素组成的纯净物。
注意:由一种元素组成的物质可能不是单质,可能是混合物,但肯定不可能是化合物;
由同种分子构成的物质肯定是纯净物。例:金刚石和石墨。
氧化物:由两种元素组成的,其中一种是氧元素的化合物。例:CO2
5、分子是维持物质化学性质的最小粒子(原子也能维持物质的化学性质);原子是化学变化中的最小粒子。
比如:维持CO2化学性质的最小粒子是CO2分子;
维持金属铜化学性质的最小粒子是铜原子;
在电解水这一变化中的最小粒子是氢原子和氧原子。
空气
空气的成分以![]() 和
和![]() 为主,是混合物。
为主,是混合物。
2、空气中氧气含量的测定:
实验现象:①红磷燃烧时有很多白烟生成;
红磷燃烧:![]() ; font-family:;" font-size:10.5pt;font-style:normal;font-weight:normal;"=""> ②同时钟罩内水面渐渐上升,冷却后,水面上升约1/5体积。
; font-family:;" font-size:10.5pt;font-style:normal;font-weight:normal;"=""> ②同时钟罩内水面渐渐上升,冷却后,水面上升约1/5体积。
测得水面上升小于1/5体积是什么原因可能是:①红磷不足,氧气没全部消耗完;
②装置漏气;
③没冷却到室温就打开弹簧夹。
3、燃烧:可燃物跟空气中的氧气发生的一种发光发热的剧烈的氧化反应;
燃烧三要点:有可燃物与氧气接触温度达到失火点(物质的失火点不可以减少)。
水
1、氢气燃烧:![]()
2、电解水实验:![]()
电解水中正极产生氧气(怎么样验满),负极产生氢气,体积比为![]() ,水平比为
,水平比为![]() 。
。
氢气燃烧和电解水实验证明:水是由氢元素和氧元素组成的。
4、O2、H2、CO2、CO、C
1、同素异形体:__________;
(金刚石(C)、,石墨(C)、![]() ; 氧气、臭氧;红磷、白磷。)
; 氧气、臭氧;红磷、白磷。)
2、(1)实验室制O2的办法是:____________________;
‚__________。
工业上制制O2的办法是:离别液态空气(物理变化)(借助N2、 O2的沸点不同)。
(2)实验室制CO2的办法是:__________;
不可以用浓盐酸(具备非常强的挥发性,气体中含有HCl),不可以用稀硫酸(生成的CaSO4微溶于水,覆盖在大理石的表面阻止了反应的进行)。
启普发生器的原理和优点:__________。
工业上制CO2的办法是:煅烧石灰石CaCO3![]() __________________________________________________。
__________________________________________________。
(3)实验室制H2的办法是:常用锌和稀硫酸或稀盐酸
Zn+H2SO4(HCl)![]() ______________________________;
______________________________;
工业上制H2的材料:水、水煤气(H2、CO)、天然气(主要成分CH4)。
(4)实验室发生装置和集气装置的选择依据:__________。
3、氧气是一种比较活泼的气体,具备氧化性、助燃性,是一种常见的氧化剂。
C和O2反应:__________;
现象:在氧气中比在空气中更旺,发出白光。
S和O2反应:__________;
现象:在空气中淡蓝色火焰,在氧气中蓝紫色的火焰,生成刺激性气味的气体。
P和O2反应:__________;
现象:冒白烟,生成白色固体。(用于发令枪)
Mg和O2反应:__________;
现象:放出很多的热,发出耀眼的白光,生成白色固体。(用于照明弹等)
Fe和O2反应:__________;
现象:剧烈燃烧,火星四射,生成黑色固体;
预先放入少量水或一层沙,预防生成的熔化物炸裂瓶底。
CH4和O2反应:__________;
4、H2、CO、C具备一样的化学性质:①可燃性②还原性
(1)还原性 H2+CuO![]() __________ 黑色变成红色,同时有水珠出现;
__________ 黑色变成红色,同时有水珠出现;
氢气还原氧化铜实验的需要注意的地方:
①先通氢气,后加热 预防氢气与空气混合加热时发生爆炸;
②实验完后,先移开酒精灯,后停氢气 预防高温的铜与空气中氧气反应生成氧化铜。
(2)C+ CuO![]() __________黑色变成红色,同时产生使石灰水变浑浊的气体;
__________黑色变成红色,同时产生使石灰水变浑浊的气体;
(3)CO+CuO![]() ______________________________ 黑色粉末变成红色,产生使石灰水变浑浊的气体。
______________________________ 黑色粉末变成红色,产生使石灰水变浑浊的气体。
5、CO2 ①与水反应: CO2+H2O![]() ______________________________________________________________________(紫色石蕊变红色);
______________________________________________________________________(紫色石蕊变红色);
②与碱反应: CO2+Ca2![]() ______________________________(检验CO2的方程式);
______________________________(检验CO2的方程式);
③与灼热的碳反应:CO2+C![]() __________________________________________________。
__________________________________________________。
6、①除杂:CO[CO2] 通入氢氧化钠溶液 CO2+NaOH![]() __________________________________________________;
__________________________________________________;
CO2[CO]通过灼热的氧化铜 CO+CuO![]() ______________________________________________________________________;
______________________________________________________________________;
CaO[CaCO3]只能煅烧 CaCO3![]() __________________________________________________。
__________________________________________________。
②检验:CaO[CaCO3]加盐酸 CaCO3+ HC![]() __________________________________________________。
__________________________________________________。
5、溶液
1、溶液的特点:均一稳定的混合物。
①加水②升温
![]()
![]() 饱和溶液 不饱和溶液 (熟石灰对温度例外)
饱和溶液 不饱和溶液 (熟石灰对温度例外)
①增加溶质②降温③蒸发溶剂
2、溶质的水平分数(浓度):
对于饱和溶液:
3、结晶办法:蒸发结晶(适用于溶解度受温度影响小的固体,如NaCl);
‚降温结晶(适用于溶解度受温度影响大的固体,如硝酸钾)
ƒ蒸发浓缩,冷却热饱和溶液。
4、气体溶解度随温度升高而减少,随压强增大而增大。
6、水平守恒定律
1、在化学反应前后:①原子的类型没改变;
②原子的数目没增减;
③原子的水平也没变化,所以反应前后各物质的水平总和相等。
肯定不变的是:①各物质的水平总和;
②元素的类型和水平;
③原子的类型和数目。
肯定改变的是:①物质的类型;
②分子的类型。
可能改变的是:分子的数目。
7、实验部分
1:常见的仪器
A:不可以加热:量筒、集气瓶、漏斗、温度计、滴瓶、表面皿、广口瓶、细口瓶等
B:能直接加热:试管、蒸发皿、坩埚、燃烧匙
C:间接加热:烧杯、烧瓶、锥形瓶
(1)胶头滴管 用于移取和滴加少量液体。
注意: ①用时胶头在上,管口在下(预防液体试剂进入胶头而使胶头受腐蚀或将胶头里的杂质带进试液 ②滴管管口不可以伸入受滴容器(预防滴管沾上其他试剂) ③用过后应立即洗涤干净并插在洁净的试管内,未经洗涤的滴管严禁吸取别的试剂 ④滴瓶上的滴管需要与滴瓶配套用
(2)量筒 用于量取适量体积液体的仪器。
不可以①在量筒内稀释或配制溶液,决不可以对量筒加热 。
也不可以②在量筒里进行化学反应
注意: 在量液体时,要依据所量的体积来选择大小适合的量筒(不然会导致较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点维持在同一水平面。
(3)托盘天平 是一种称量仪器,一般精准到0.1克。注意:称量物放在左盘,砝码按由大到小的顺序放在右盘,取用砝码要用镊子,不可以直接用手,天平不可以称量热的物体, 被称物体不可以直接放在托盘上,要在两边先放上等水平的纸, 易潮解的药品或有腐蚀性的药品(如氢氧化钠固体)需要放在玻璃器皿中称量。
(4)集气瓶 ①用于采集或贮存少量的气体 ②也可用于进行某些物质和气体的反应。
(5)广口瓶 (内壁是磨毛的) 常用于盛放固体试剂,也可用做洗气瓶
(6)细口瓶 用于盛放液体试剂 ,棕色的细口瓶用于盛装需要避光保存的物质,存放碱溶液时试剂瓶应用橡皮塞,不可以用玻璃塞。
(7)长颈漏斗 用于向反应容器内注入液体,若用来制取气体,则长颈漏斗的下端管口要插入液面以下,形成“液封”,(预防气体从长颈斗中逸出)
(8)酒精灯 酒精灯内的酒精不能超越其容积的2/3,也不能少于其容积的1/4。
①用前先检查灯心,绝对禁止向燃着的酒精灯里添加酒精
②也不可用燃着的酒精灯去点燃另一酒精灯(以免着火)
③酒精灯的外焰最高, 应在外焰部分加热 先预热后集中加热。
④要预防灯心与热的玻璃器皿接触(以防玻璃器皿受损)
⑤实验结束时,应用灯帽盖灭(以免灯内酒精挥发而使灯心留有过多的水分,不只浪费酒精而且不容易点燃),决不可以用嘴吹灭(不然可能引起灯内酒精燃烧,发生危险)
⑥万一酒精在桌上燃烧,应立即用湿抹布扑盖。
2:基本操作
(1) 药剂的取用:“三不准”①不准用手接触药品 ②不准用口尝药品的味道 ③不准把鼻孔凑到容器口去闻气味
(2)物质的加热 试管夹应夹在试管的中上部,铁夹应夹在离试管口的1/3处。
A:给试管中的液体加热时试管内的液体不能超越试管容积的1/3,反应时试管内的液体低于试管容积的1/2。试管一般与桌面成45°角,先预热后集中试管底部加热,加热时切不可对着其他人
B:给试管里的固体加热: 试管口应略向下(预防产生的水倒流到试管底,使试管破裂)先预热后集中药品加热
(3) 溶液的配制
A:物质的溶解 加速固体物质溶解的办法有搅拌、振荡、加热、将固体研细
B:浓硫酸的稀释 因为浓硫酸易溶于水,同时放出很多的热,所以在稀释时必须要把浓硫酸沿器壁慢慢地注入水中,切不可把水倒入浓硫酸中(酸入水)
(4)过滤 是离别不溶性固体与液体的一种办法(即一种溶,一种不溶,肯定用过滤办法)如粗盐提纯、氯化钾和二氧化锰的离别。
操作要素:“一贴”、“二低”、“三靠”
“一贴” 指用水润湿后的滤纸应紧贴漏斗壁;
“二纸”指①滤纸边缘稍低于漏斗边缘②滤液液面稍低于滤纸边缘;
“三靠”指①烧杯紧靠玻璃棒 ②玻璃棒紧靠三层滤纸边 ③漏斗末端紧靠烧杯内壁
(5) 蒸发与结晶 A、蒸发是浓缩或蒸干溶液得到固体的操作,仪器用蒸发皿、 玻璃棒、酒精灯、铁架台
注意点:①在蒸发过程中要不断搅拌,以免液滴飞溅,②当出现很多固体时就停止加热③用蒸发皿应用坩埚钳夹持,后放在石棉网上
B、结晶是离别几种可溶性的物质①若物质的溶解度受温度变化的影响不大,则可使用蒸发溶剂的办法;②若物质的溶解度受温度变化的影响较大的,则用冷却热饱和溶液法。
(6)仪器的装配 装配时, 一般按从低到高,从左到右的顺序进行。
(7)检查装置的气密性 先将导管浸入水中,后用手掌紧物捂器壁(现象:管口有气泡冒出,当手离开后导管内形成一段水柱。
(8)玻璃仪器清洗干净的规范是:仪器内壁上的水即不聚成水滴,也不成股流下,而均匀地附着一层水膜时,就表明已洗涤干净了。
3、气体的制取、采集
(1)常用气体的发生装置
A:固体之间反应且需要加热,用制O2装置(NH3、CH4);必须要用酒精灯。
B:固体与液体之间且无需加热,用制H2装置(CO2);肯定无需酒精灯。
(2)常用气体的采集办法
A:排水法 适用于难或不溶于水且与水不反应的气体,导管稍稍伸进瓶内,(CO、N2、NO只可以用排水法)
B:向上排空气法 适用于密度比空气大的气体(CO2、HCl只可以用向上排空气法)
C:向下排空气法 适用于密度比空气小的气体 排气法:导管应伸入瓶底
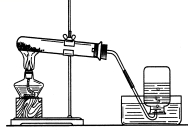 4、气体的验满:
4、气体的验满:
O2的验满:用带余烬的木条放在瓶口。
CO2的验满:用燃着的木条放在瓶口。证明CO2的办法是用澄清石灰水。
5、容易见到气体的净化和干燥 肯定先净化后干燥
(1)气体的净化(除杂)
H2(HCl)用NaOH溶液 CO(HCl)用NaOH溶液 CO(CO2)用NaOH 溶液
CO2(HCl)用NaHCO3溶液 CO2(H2、CO)用CuO CO(O2)用铜网
O2(CO2、HCl、H2O)用碱石灰(CaO和NaOH的混合物)
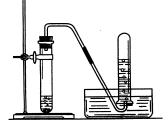 (2)气体的干燥(除去水)
(2)气体的干燥(除去水)
干燥剂有浓硫酸、碱石灰、固体氢氧化钠、氧化钙、无水硫酸铜;
酸性干燥剂(浓硫酸)不可以干燥碱性气体如氨气;
碱性干燥剂(NaOH )不可以干燥酸性气体如二氧化硫、二氧化碳、、氯化氢等。
注意:证明时,必须要先证明水再证明其它物质,证明水必须要用无水硫酸铜;
除去水时,先除去杂质,再除去水 。证明二氧化碳必须要用澄清石灰水。
6、指示剂的用法 用指示剂只能说明溶液呈酸性或碱性,不可以确定溶液肯定是酸或碱。操作办法:用玻璃棒沾取少量被测溶液滴在试纸上,绝不可以将试纸伸入待测试液中,更不可以将试纸投入到待测溶液中去。
紫色石蕊遇酸性溶液显红色,遇碱性溶液显蓝色;
无色酚酞遇酸性溶液不变色,遇碱性溶液显红色。
7、地壳含量最多的元素是O、 Si 、Al 、Fe。
化学价口诀
钾钠银氢正一价,氟氯溴碘负一价;
钙镁铜钡锌正二价,一般氧为负二价;
二三铁,二四碳,二四六硫,三铝四硅,单质化合价为零。







