第六单元 碳和碳的氧化物 课题3 二氧化碳和一氧化碳(讲学)
__________
初步掌握在实验室中制取二氧化碳。
知道二氧化碳和一氧化碳的性质
知道并关注温室效应
__________
____________________
1.二氧化碳__________,也__________,可用燃着的木条检查集气瓶是不是已采集满二氧化碳。检查时,木条应放在瓶口。
2.二氧化碳与水反应,其化学方程式为:H2O+CO2![]() H2CO3,碳酸能使紫色石蕊溶液变红色。碳酸非常不稳定,在加热条件下又会分解生成二氧化碳和水:H2CO3
H2CO3,碳酸能使紫色石蕊溶液变红色。碳酸非常不稳定,在加热条件下又会分解生成二氧化碳和水:H2CO3![]() H2O+CO2↑。
H2O+CO2↑。
3.二氧化碳与澄清石灰水反应的化学方程式:CO2+Ca2![]() CaCO3↓+H2O,此反应可用于检验二氧化碳。
CaCO3↓+H2O,此反应可用于检验二氧化碳。
4.预防温室效应的手段:降低化石燃料的燃烧;开发新能源;植树造林,严禁乱砍滥伐森林等。
5.一氧化碳的化学性质
一氧化碳的__________:2CO+O2![]() 2CO2。
2CO2。
一氧化碳具备__________:极易与血液中的血红蛋白结合,从而使血红蛋白不可以非常不错与氧气结合,导致生物体内缺氧。
一氧化碳的__________:CuO+CO![]() Cu+CO2。实验装置:
Cu+CO2。实验装置:

反应现象:①黑色固体变成红色;②澄清石灰水变浑浊。实验步骤: ①先通入CO一会儿;②加热;③停止加热;④继续通入CO到玻璃管冷却为止。

要点1、二氧化碳的物理性质
____________________
1.在一般情况下,二氧化碳是一种无色无味的气体。在标准情况下,二氧化碳的密度是1.977 g/L,约是空气密度的1.5倍。
验证CO2是不是集满的办法,见下表。
实验步骤 | 实验现象 | 实验结论 |
制取并采集二氧化碳,依据二氧化碳不燃烧也不支持燃烧的性质,可用燃着的木条检查集气瓶是否已采集满二氧化碳,检查时燃着的木条应放在集气瓶口 | 若燃着的木条熄灭,则说明集气瓶中的二氧化碳已采集满 | 二氧化碳比空气重,沉在集气瓶底部,采集二氧化碳时可使用向上排空气法 |
将二氧化碳气体从集气瓶倾倒入烧杯中,见下表。
实验步骤 | 实验现象 | 实验结论 |
将CO2气体慢慢倒入烧杯中
| 两支蜡烛自下而上依次熄灭 | 二氧化碳不燃烧,通常情况下也不支持燃烧,其密度比空气大 |
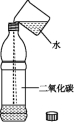
2.二氧化碳能溶于水。在一般情况下,1体积的水约能溶解1体积的二氧化碳。
实验步骤 | 实验现象 | 实验结论 |
向一个采集满二氧化碳气体的质地较软的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,振荡
| 瓶子变瘪 | 二氧化碳能溶于水,使瓶内的气体体积减小,因而压强减小,外面大方压把瓶子压瘪了 |
二氧化碳加压降温可以变成雪花状固体,这种固体俗称__________。
____________________
【考试试题示例】
二氧化碳与大家的生产和生活有着广泛的联系,下列关于二氧化碳的认识中,正确的一组是
①在地窖、枯井内二氧化碳含量会比较高
②二氧化碳在水中的溶解量跟压强成反比
③绿色植物光合用途时吸收二氧化碳并放出氧气
④二氧化碳比一氧化碳多一个氧原子
A.①② B.③④ C.①③ D.②④
【答案】C
【分析】因为二氧化碳的密度比空气大且在地窖和枯井内空气流通不畅,所以二氧化碳的含量一般比较高;气体在水中的溶解量一般随压强的增大而增大,溶解量跟压强成正比;光合用途吸收二氧化碳放出氧气;一个二氧化碳分子比一个一氧化碳分子多一个氧原子,而不可以说二氧化碳比一氧化碳多一个氧原子。
要点2:二氧化碳的化学性质
____________________
1.二氧化碳不燃烧,也不支持燃烧,不可以供给呼吸。
2.二氧化碳与水反应生成碳酸,其化学式为:H2O+CO2![]() H2CO3,碳酸能使紫色石蕊溶液变红色。它不稳定,在加热条件下又会分解生成二氧化碳和水:H2CO3
H2CO3,碳酸能使紫色石蕊溶液变红色。它不稳定,在加热条件下又会分解生成二氧化碳和水:H2CO3![]() H2O+CO2↑。
H2O+CO2↑。
实验目的:探究二氧化碳与水能否发生反应。
实验步骤、现象和结论如下表。
实验步骤 | 实验现象 | 实验结论 |
取四朵用石蕊溶液染成紫色的干燥的纸花 ①将第一朵纸花喷上稀醋酸 ②将第二朵纸花喷上水 ③将第三朵纸花直接放入盛满二氧化碳的集气瓶中 ④将第四朵纸花喷上水后,再放入盛满二氧化碳的集气瓶中 察看四朵花的颜色变化 ⑤将第四朵纸花取出,小心烘烤,察看现象 | ①第一朵纸花变红色 ②第二朵纸花没变色 ③第三朵纸花没变色 ④第四朵纸花变红色 ⑤纸花由红色变成紫色 | ①说明酸能使石蕊溶液变红 ②说明水不可以使石蕊溶液变色 ③二氧化碳气体不可以使石蕊溶液变色 ④说明二氧化碳能与水反应生成碳酸,碳酸能使石蕊溶液变红 ⑤碳酸可以分解 |
3.二氧化碳与澄清石灰水的反应:CO2+Ca2 ![]() CaCO3↓+H2O。
CaCO3↓+H2O。
现象:澄清的石灰水变浑浊。
应用:此办法可用于检验二氧化碳。
易错警示
二氧化碳能溶于水和二氧化碳与水反应在本质上是有差异的,前者是二氧化碳的物理性质,后者才是二氧化碳的化学性质。当二氧化碳通入水中时,仅有10%的二氧化碳与水发生了反应,其余的90%仍以二氧化碳的形式存在。
__________。
碳酸具备酸性,而二氧化碳不具备酸性,__________。
____________________
【考试试题示例】
某同学设计了如图所示的一组实验。取4朵用石蕊试液染成紫色的干燥纸花,分别按下图进行实验。回答下列问题:

察看到纸花的颜色变化是:Ⅰ.纸花变红;Ⅱ.__________;Ⅲ.纸花不变色;Ⅳ.__________。
该同学进行的Ⅰ、Ⅱ两项实验,说明什么?__________。
该同学进行4组对比实验的目的是什么?__________。
写出实验Ⅳ中发生反应的化学方程式__________。
【答案】 纸花不变色;纸花变红
稀醋酸能使紫色石蕊变红,水不可以使紫色石蕊变色
证明水和二氧化碳不使紫色石蕊变色,酸能使紫色石蕊变红,二氧化碳溶于水可生成酸
H2O+CO2![]() H2CO3
H2CO3
【分析】本题是探究性实验题,通过对比实验,得出结论:水不可以使小花变色,说明水不显酸性;干燥的小花直接放入二氧化碳气体中小花不变色,说明二氧化碳本身不显酸性;干燥小花喷水后放入二氧化碳气体中,小花变红色,说明了水与二氧化碳反应生成了能使小花变色的物质。
要点3、二氧化碳的作用
____________________
CO2的性质 | 用途 |
不可以燃烧,也不支持燃烧,密度比空气大 | 用来灭火 |
CO2+H2O | 光合用途 |
用CO2、H2O、NaCl等生产纯碱 | 化工材料 |
干冰升华吸热 | 制冷剂,人工降雨等例 |
____________________
【考试试题示例】
下列关于二氧化碳的作用中,既跟它的物理性质有关,也跟它的化学性质有关的是
A.人工降雨 B.植物的光合用途 C. 灭火 D.用作化工材料
【答案】C
【分析】灭火时既借助二氧化碳不可以燃烧、不支持燃烧这一化学性质,又借助二氧化碳的密度比空气大这一物理性质。
要点4、二氧化碳对生活和环境的影响
____________________
1.二氧化碳对人体健康的影响:进入久未开启的菜窖或干涸的深井之前可以预先做灯火试验,假如灯火燃烧不旺盛或熄灭,可知二氧化碳浓度较大,人不适合进入。
2.温室效应
温室效应的产生:由于能源消耗增多,森林遭到破坏,大方中CO2的含量不断上升,使地面吸收的太阳光的热量不容易散失,从而使全球变暖,这种现象叫“温室效应”。
温室效应的害处及预防手段,见下表。
主要风险 | 预防手段 |
全球变暖将可能致使两极的冰川融化,使海平面升高,淹没部分沿海城市,与使土地沙漠化、农业减产等 | ①__________ ②__________ ③__________ |
易错警示
二氧化碳并非能产生温室效应的唯一气体,还有臭氧、甲烷和氟氯代烷等。
____________________
【考试试题示例】
现在,全世界气候变化出现异常,专家对此现象展开了激烈讨论,因此与碳有关的词语飞速流传开来。
大方中二氧化碳含量不断上升的重要原因是__________。
碳汇可理解为绿色植物吸收并储存二氧化碳的能力,绿色植物通过__________用途吸收二氧化碳。
低碳经济是以低能耗、低污染、低排放为基础的经济模式。下列做法符合“低碳经济”理念的是__________。
①大力进步火力发电②大力进步新能源汽车③优化建筑设计,推广节能建筑
【答案】含碳燃料的很多用或工业上排放很多的二氧化碳等光合②、③
【分析】导致空气中二氧化碳的含量不断上升的重要原因有:含碳燃料的很多用、工业排放的废气含很多二氧化碳及大面积地破坏森林和植被。植物通过光合用途吸收二氧化碳,并放出氧气,通过呼吸用途吸收氧气,排出二氧化碳。“低碳经济”就是要降低二氧化碳的排放,而大力进步火力发电会产生很多的二氧化碳气体。
要点5:一氧化碳性质与作用与功效
____________________
1、一氧化碳的物理性质
一氧化碳是一种无颜色无气味的气体,__________。
拓展延伸
一氧化碳的密度比空气略小,不可以用排空气法采集。它难溶于水,因此可用排水法采集。
2、一氧化碳的化学性质
1.一氧化碳的可燃性
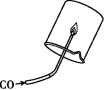
一氧化碳燃烧产生蓝色火焰,并放出热量。将一个内壁涂有澄清石灰水的烧杯罩在火焰上方,发现石灰水变浑浊,证明有二氧化碳生成,这是检验一氧化碳的办法。化学方程式为:2CO+O2![]() 2CO2。
2CO2。
2.一氧化碳的还原性
CO与CuO反应的方程式为:CuO+CO![]() Cu+CO2。
Cu+CO2。
实验装置。
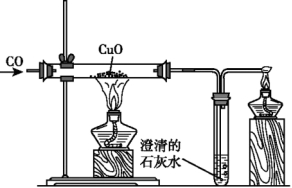
反应现象:①黑色固体变成红色;②澄清石灰水变浑浊。
实验步骤:①先通入一会儿CO;②加热;③停止加热;④继续通入CO到玻璃管冷却为止。
说明:①__________。 ②__________。③__________。④__________。
拓展延伸
CO还原CuO是初中阶段一个尤为重要的实验。在本实验中着重注意以下几个问题:①化学反应的方程式;②反应的现象;③CO的验纯;④实验操作步骤:先通CO后加热,实验完毕,要先停止加热,再继续通CO至玻璃管冷却;⑤CO尾气的处置。
一氧化碳的毒性:一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不可以非常不错地与氧气结合,导致生物体内缺氧,紧急时会危及生命。
3、一氧化碳的作用
借助一氧化碳的可燃性,可用作燃料;借助一氧化碳的还原性,可用于冶金工业。
____________________
【考试试题示例】
1、下列说法中,正确的是
A.煤炉上放一壶水可以预防CO中毒
B.金刚石、石墨都是由碳原子构成的,所以都非常坚硬
C.用活性炭可以除去水中的氯化钠杂质
D.用澄清石灰水可区别CO、CO2
【答案】D
【分析】CO难溶于水且不与水反应,所以在煤炉上放一壶水不可以预防CO中毒,故A错误;金刚石和石墨虽然都是由碳原子构成的,但碳原子的排列方法不同,物理性质有非常大差异,金刚石非常硬,但石墨非常软,故B错误;活性炭具备吸附性,可以除去颜色和异味,但不可以除去水中的氯化钠,故C错误;二氧化碳可使澄清石灰水变浑浊,一氧化碳不可以,因此可用澄清石灰水区别一氧化碳和二氧化碳,D正确。
2、注意观察在煤炉中燃烧的煤,你会发现有如图所示的现象。请你指出在图中蓝色火焰处发生的反应的化学方程式
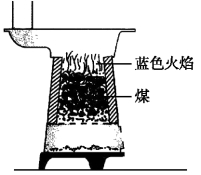
A.C+O2![]() CO2 B.2C+O2
CO2 B.2C+O2![]() 2CO C.2CO+O2
2CO C.2CO+O2![]() 2CO2 D.CO2+C
2CO2 D.CO2+C![]() 2CO
2CO
【答案】C
【分析】碳燃烧没火焰产生;二氧化碳与碳反应转化为一氧化碳是吸热反应,没火焰产生;一氧化碳燃烧产生蓝色火焰。
__________
1、【2018年山东威海中考化学考试试题】据《中国环境报》报道,为应付气候变化,落实《巴黎气候变化协定》,2017年国家打造了统一的碳排放权买卖市场,按国际惯例,这里的“碳”是指
A.二氧化碳 B.单质碳 C.碳元素 D.所有含碳化合物
【答案】A
【分析】2017年国家打造了统一的碳排放权买卖市场,这里的“碳”是指二氧化碳,故选A。
2、【2017年山东威海中考化学考试试题】关于碳循环和氧循环,下列说法不正确的是
A.碳循环和氧循环分别是指二氧化碳和氧气的循环
B.碳循环和氧循环过程中均发生了化学变化
C.绿色植物的成长过程,既涉及碳循环,又涉及氧循环
D.碳循环和氧循环有益于保持大方中氧气和二氧化碳含量的相对稳定
【答案】A
【分析】A.碳循环和氧循环分别是指含碳物质和含氧物质的循环;B.碳循环和氧循环过程中均有物质类型改变,都发生了化学变化C.绿色植物的成长过程,既涉既有含碳化合物的转化即碳循环,又涉及含氧物质的转化即氧循环;D.碳循环和氧循环有益于保持大方中氧气和二氧化碳含量的相对稳定正确,选A
3、【2018年江苏扬州中考化学考试试题】铜元素有多种氧化物,如CuO、Cu2O。称取14.4 g仅含Cu、O两种元素的固体样品、使用如下装置实验。测得实验前后装置B增重4.4g。下列说法正确的是

A.装置B有哪些用途是吸收反应生成的H2O和CO2
B.实验开始前应先关闭K2,打开K1,让CO通一段时间
C.依据实验数据进行计算,可以确定该固体为Cu2O
D.若缺少装置C,则实验所得Cu、O个数比偏高
【答案】B
【分析】A、装置A中的反应是CuO+CO![]() Cu+CO2,Cu2O+CO
Cu+CO2,Cu2O+CO![]() 2Cu+CO2,反应中没生成水,装置B有哪些用途是吸收反应生成的CO2,错误;B、一氧化碳是具备可燃性的气体,实验开始前应先关闭K2,打开K1,让CO通一段时间,排尽玻璃管中空气,预防加热时发生爆炸,正确。C、由题意可知装置B增重4.4g,是吸收二氧化碳的水平,由水平守恒定律可知,铜的氧化物中氧元素的水平是:4.4g×
2Cu+CO2,反应中没生成水,装置B有哪些用途是吸收反应生成的CO2,错误;B、一氧化碳是具备可燃性的气体,实验开始前应先关闭K2,打开K1,让CO通一段时间,排尽玻璃管中空气,预防加热时发生爆炸,正确。C、由题意可知装置B增重4.4g,是吸收二氧化碳的水平,由水平守恒定律可知,铜的氧化物中氧元素的水平是:4.4g×![]() ×100%× =1.6g,铜原子与氧原子的个数比=
×100%× =1.6g,铜原子与氧原子的个数比=![]() :
:![]() =2:1,所以确定该固体为Cu2O或Cu和CuO的混合物或Cu2O、Cu和CuO的混合物,错误;D、若缺少装置C,装置B增重的水平偏大,则实验所得Cu、O个数比偏低,错误。故选B。
=2:1,所以确定该固体为Cu2O或Cu和CuO的混合物或Cu2O、Cu和CuO的混合物,错误;D、若缺少装置C,装置B增重的水平偏大,则实验所得Cu、O个数比偏低,错误。故选B。
__________
1、O2和O2是自然界中生命活动不可或缺的两种气体,下列对它们的认识中,正确的是
A.都含有氧分子 B.都能供动物呼吸
C.都不溶于水 D.密度都比空气大
【答案】D
【分析】氧气中含有氧分子,而二氧化碳中不含氧分子,故A错误;二氧化碳不可以供给呼吸,故B错误;氧气不容易溶于水,而二氧化碳能溶于水,故C错误;二氧化碳和氧气的密度均比空气大,都可以用向上排空气法采集。
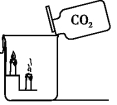
2、将制得的二氧化碳气体依次通过图所示的装置,写出A、B两装置中可察看到的实验现象和得出的结论。
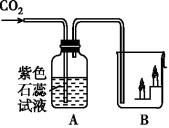
A装置:现象__________;验证的性质__________。
B装置:现象__________;验证的性质__________。
【答案】紫色石蕊试液变为红色;二氧化碳能与水反应产生碳酸;下层蜡烛先熄灭,上层蜡烛后熄灭;二氧化碳不可以燃烧,不支持燃烧,密度比空气大
【分析】此题综合考查了二氧化碳的性质,包含:二氧化碳与水的反应,二氧化碳不可以燃烧,不支持燃烧,密度比空气大。A装置通过紫色石蕊试液变红,可以证明二氧化碳能与水反应生成碳酸;B装置通过下层蜡烛先灭,上层蜡烛后灭,可以证明二氧化碳不支持燃烧,不可以燃烧,而且密度比空气大的性质。
3、一氧化碳和二氧化碳只有一字之差。
有人觉得,二者就像孪生兄弟,这是由于__________。
A.它们由同种分子构成 B.它们由相同的元素组成
C.它们都有毒 D.它们都能溶于水
也有人觉得,二者化学性质相差甚远,请给出一条支持他的原因__________。
【答案】B一个二氧化碳分子比一个一氧化碳分子多一个氧原子
【分析】二氧化碳与一氧化碳是由不同分子构成的,但组成元素相同,其中CO有毒,不溶于水,而CO2无毒,可以溶于水。因为CO和CO2的组成不同,故它们在性质上存在非常大的差异。
4、小平同学设计了如图所示的实验装置,进行一氧化碳还原氧化铜的实验。试回答:
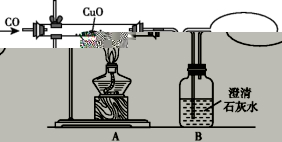
当装置B中的澄清石灰水变浑浊时,说明__________。
为了保证安全,在通入CO气体之前应该__________。
【答案】反应有CO2气体生成检验CO气体的纯度
【分析】澄清石灰水的主要用途是验证一氧化碳与氧化铜反应后是不是有二氧化碳生成,而气球有哪些用途是采集未反应的一氧化碳,预防排放到空气中引起空气污染。一氧化碳是一种可燃性气体,为了保证安全、预防发生爆炸事故,在加热或点燃之前必须要检验它的纯度。